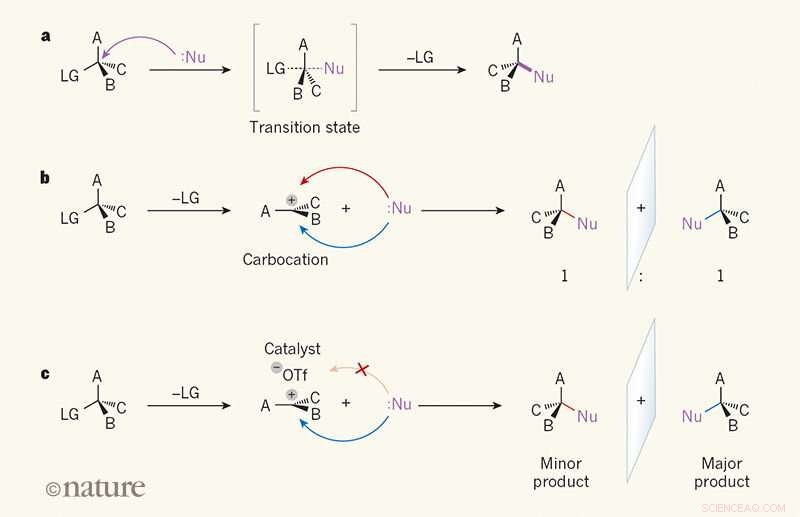
Selectividad de imagen especular en reacciones de sustitución. a, En una reacción SN2, un reactivo llamado nucleófilo (Nu; los puntos indican un par solitario de electrones) ataca a un átomo de carbono en una molécula orgánica desde el lado opuesto a un grupo "saliente" (LG). A, B y C pueden ser cualquier átomo o grupo. En el estado de transición, el enlace entre el átomo de carbono y el LG está parcialmente roto, y se forma parcialmente un enlace entre Nu y el átomo de carbono (los enlaces parcialmente rotos y parcialmente formados se muestran como líneas discontinuas). El vínculo con el LG luego se rompe, y se forma un solo producto. B, En la reacción SN1, el LG se lanza primero, y un plano, intermedio cargado llamado formas carbocatiónicas. Debido a que el Nu puede atacar el carbocatión con la misma facilidad desde cualquier lado, el producto se forma como una proporción 1:1 de isómeros de imagen especular (enantiómeros). C, Wendlandt et al.1 informan de una reacción SN1 en la que un catalizador de molécula pequeña y un ion triflato (–OTf) se unen a un lado del carbocatión, dirigiendo al nucleófilo al otro lado. Por tanto, se produce preferentemente un enantiómero. Crédito: Naturaleza (2018). DOI:10.1038 / s41586-018-0042-1
Un equipo de investigadores de la Universidad de Harvard en los EE. UU. Ha desarrollado una forma de hacernos una reacción SN1 para crear estereocentros de carbono cuaternario. En su artículo publicado en la revista Naturaleza , el equipo describe cómo superar la tendencia de las reacciones SN1 a destruir la estereoquímica para producir el material centrado en carbono. Tobias Morack y Ryan Gilmour de la Universidad de Münster en Alemania, ofrecer un artículo de Noticias y opiniones sobre el estudio en el mismo número de la revista.
Como señalan los investigadores, hasta ahora, No ha habido un buen método para hacer estereocentros cuaternarios. Métodos actuales, ellos notan, tienden a basarse en sustratos pro-quirales, que son en sí mismos un desafío. En este nuevo esfuerzo, el equipo de Harvard ideó un nuevo enfoque, uno basado en la reacción de SN1.
Las reacciones SN1 son un pilar de los cursos de introducción a la química orgánica, pero notoriamente causan estragos en la estereoquímica. A pesar de eso, los investigadores creían que podían utilizar como sustrato el intermedio de carbocatión plano producido en tales reacciones. Con ese fin, se les ocurrió una reacción SN1 que convirtió una mezcla de acetato de propargilo (con cantidades iguales de enantiómeros izquierdos y diestros, un racémico) en una mezcla con un centro cuaternario. Se usó un donante de enlaces de hidrógeno como catalizador para eliminar los materiales acetoxi que se reemplazaron con una mezcla de alilo; el resultado fue un solo enantiómero.
Los productos finales fueron interesantes, Nota de Morack y Gilmour, porque los estereocentros de carbono tenían una amplia gama de orbitales de electrones. Esto significa que tienen diferentes geometrías físicas y, por lo tanto, reaccionan de manera diferente. Esto abre la puerta a su uso para producir una amplia variedad de moléculas que podrían usarse en diversas reacciones para sintetizar nuevos productos químicos.
Los investigadores señalan que no han terminado con el trabajo; planean probar el mismo enfoque con compuestos que no son tan estables. Haciéndolo, ellos reconocen, requerirá el uso de un catalizador que sea aún más reactivo. También planean estudiar la posibilidad de realizar la reacción con diferentes nucleófilos.
© 2018 Phys.org