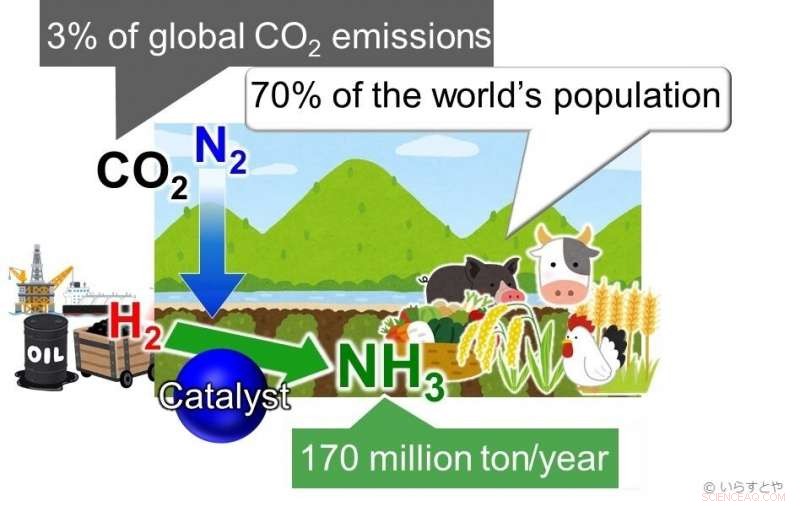
El amoníaco (NH3) es uno de los productos químicos industriales más importantes en la actualidad, sintetizados a nivel mundial para su uso en fertilizantes que luego permiten la producción de alimentos para aproximadamente el 70% de la población mundial. Actualmente, el amoniaco se obtiene haciendo reaccionar nitrógeno (N2) del aire con hidrógeno (H2). Esta reacción requiere mucha energía y es, por lo tanto, alimentado por combustibles fósiles, contribuyendo a más del 3% de las emisiones globales de CO2. Crédito:Irasutoya, Michikazu Hara
Los científicos del Instituto de Tecnología de Tokio (Tokyo Tech) han desarrollado un catalizador mejorado tomando el hidruro de calcio, un agente deshidratante común, y agregándole fluoruro. El catalizador facilita la síntesis de amoníaco a solo 50 ° C, utilizando solo la mitad de la energía que requieren las técnicas existentes. Esto abre las puertas a la producción de amoníaco con un bajo consumo de energía y una reducción de las emisiones de gases de efecto invernadero.
El amoníaco es fundamental para la fabricación de fertilizantes para plantas, que a su vez alimenta aproximadamente al 70% de la población mundial. En la industria, el amoníaco se produce mediante el proceso Haber-Bosch, donde el metano reacciona primero con vapor para producir hidrógeno, y luego se hace reaccionar hidrógeno con nitrógeno para dar amoniaco. El problema con este proceso es que a medida que aumenta la temperatura, el rendimiento disminuye. Para seguir obteniendo un buen rendimiento, es necesario aumentar la presión aplicada en la cámara de reacción. Esto requiere mucha energía. Más lejos, los catalizadores a base de hierro usados para la reacción solo son efectivos por encima de 350 ° C. Mantener temperaturas tan altas también requiere una cantidad significativa de energía. Para colmo, el rendimiento es solo del 30-40%.
Actualmente se utilizan combustibles fósiles para impulsar el proceso, contribuyendo grandes cantidades de dióxido de carbono a la atmósfera. Alternativas de recursos renovables, como la energía eólica, han sido aplicados, pero esos no han demostrado ser sostenibles. Para aumentar el rendimiento y reducir el daño al medio ambiente, por lo tanto, la reacción debe tener lugar a bajas temperaturas. Para que esto suceda, Se requieren catalizadores que permitan la reacción a bajas temperaturas.
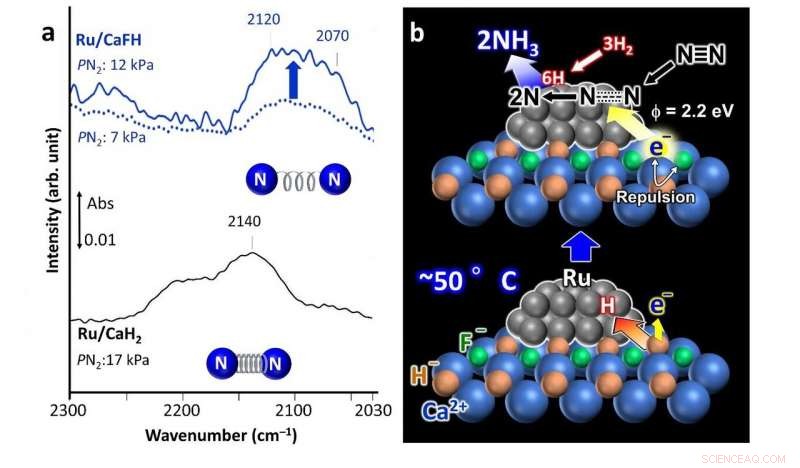
a) Espectros infrarrojos en forma de Fourier (FT-IR) para la adsorción de nitrógeno en el catalizador Ru / CaFH que contiene fluoruro desarrollado (arriba) que muestra un enlace debilitado entre los átomos de nitrógeno en comparación con un catalizador Ru / CaH2 no modificado (espectro inferior). b) Mecanismo de reacción propuesto utilizando el catalizador Ru / CaFH. Crédito: Comunicaciones de la naturaleza
Hasta aquí, tales catalizadores han sido esquivos para los científicos. "Los catalizadores convencionales pierden la actividad catalítica para la formación de amoníaco a partir de N 2 y H 2 gases a 100-200 ° C, incluso si exhiben un alto rendimiento catalítico a altas temperaturas, "comenta un grupo de científicos de Tokyo Tech, Japón, que parecen haber resuelto finalmente el problema del catalizador. Los científicos, dirigido por el doctor Michikazu Hara, desarrolló un catalizador que es eficaz incluso a 50 ° C. "Nuestro catalizador produce amoníaco a partir de N 2 y H 2 gases a 50 ° C con una energía de activación extremadamente pequeña de 20 kJmol -1 , que es menos de la mitad de lo informado para los catalizadores convencionales, "El Dr. Hara y sus colegas informan en su artículo publicado en Comunicaciones de la naturaleza .
Su catalizador comprende una solución sólida de CaFH, con nanopartículas de rutenio (Ru) depositadas en su superficie. La adición de fluoruro (F - ) al hidruro de calcio (CaH 2 ), un agente deshidratante común, es lo que hace que el catalizador sea eficaz a temperaturas y presiones más bajas. Después de realizar análisis espectroscópicos y computacionales, los científicos proponen un posible mecanismo por el cual el catalizador facilita la producción de amoniaco.
El enlace calcio-fluoruro (Ca-F) es más fuerte que el enlace calcio-hidrógeno (Ca-H). Entonces, la presencia del enlace Ca-F debilita el enlace Ca-H y el Ru es capaz de extraer átomos de H del cristal del catalizador, dejando electrones en su lugar. Los átomos de H luego se desorben de las nanopartículas de Ru como H 2 gas. Esto ocurre incluso a 50 ° C. La repulsión de carga resultante entre los electrones atrapados y F - iones en el cristal bajan las barreras de energía para que estos electrones se liberen, dando así al material una alta capacidad de donación de electrones. Estos electrones liberados atacan los enlaces entre los átomos de nitrógeno en el N 2 gas, facilitando la producción de amoniaco.
Este nuevo método de producción de amoníaco reduce la demanda de energía, reduciendo así las emisiones de dióxido de carbono por el uso de grandes cantidades de combustibles fósiles. Los hallazgos de este estudio iluminan la posibilidad de un proceso Haber-Bosch ambientalmente sostenible, abriendo la puerta a la próxima revolución en la producción agrícola de alimentos.