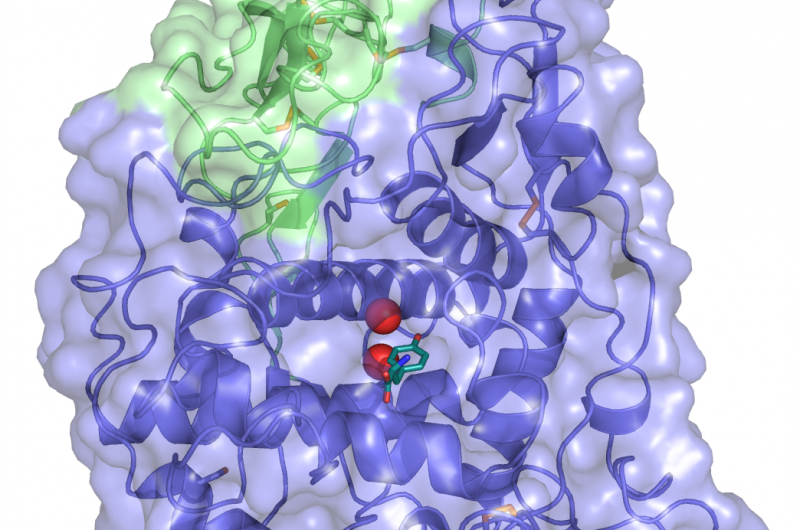
Una estructura cristalina de TYRP1. Tirosina (el sustrato metabolizado por TYPR1, en color deepteal) está vinculado al sitio activo, donde los iones de zinc metálico (esferas rojas) coordinan el papel funcional. Crédito:Montse Lopez
Un nuevo avance abre las puertas para tratar las afecciones de la piel relacionadas con la melanina
Las manchas resultantes de una exposición excesiva al sol y otros efectos de la producción disfuncional de melanina pueden convertirse en cosa del pasado. Los científicos han resuelto la estructura de una de las tres enzimas que generan melanina en humanos, abriendo puertas al diseño de compuestos blanqueadores para eliminar las decoloraciones de la piel. El estudio fue publicado en Angewandte Chemie
El verano es a menudo sinónimo de gente descansando en las playas tratando de broncearse. Con la edad y la exposición frecuente al sol, algunas personas pueden desarrollar las llamadas "manchas de la edad" o "manchas del hígado", que son pequeñas áreas oscuras en la piel. Deshacerse de estos es un desafío y los investigadores y la industria cosmética están tratando de encontrar una manera de eliminarlos a largo plazo.
Ahora, un equipo de investigadores de la ESRF, La Universidad de Groningen y Wageningen Food and Biobased Research (Países Bajos) acaba de descifrar una de las tres enzimas que generan melanina, el pigmento que da la piel, cabello y ojos de su color. Cuando estas enzimas no funcionan correctamente, crean trastornos de pigmentación:manchas en la piel, albinismo o melanoma.
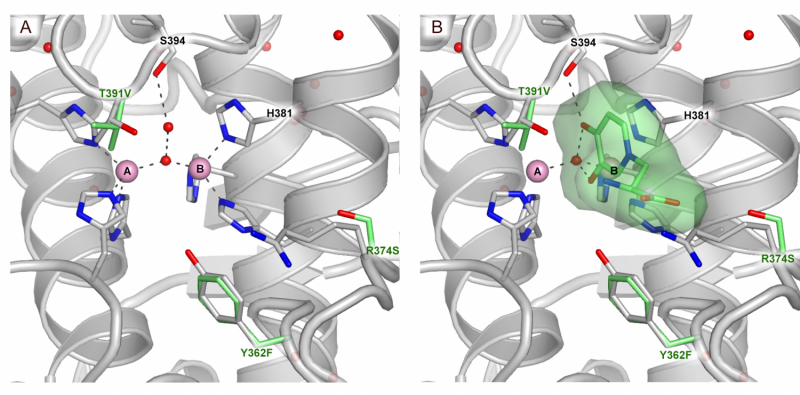
Un modo de unión a sustrato del sitio activo TYRP1. (A) Sitio activo del sitio activo TYRP1 (B) de TYRP1 con sustrato unido. Crédito:@Montse lopez
Hasta hoy, las estructuras de estas tres enzimas eran desconocidas, por lo que los científicos han estado usando las enzimas fúngicas o vegetales para sintetizar compuestos dirigidos a los humanos. El desafío de resolver estas estructuras radica en que los científicos no saben cómo funcionan estas enzimas para producir melanina y nunca han logrado purificar la versión humana en grandes cantidades para estudiarlas.
Hallazgos inesperados
Xuelei Lai, primer autor del estudio, centrado en enzimas humanas en lugar de enzimas vegetales. Explica que "hemos logrado purificar y cristalizar la tirosinasa y la proteína 1 relacionada con la tirosinasa (TYRP1) y hemos resuelto la estructura de la TYRP1. Esta es la primera estructura disponible para una enzima melanogénica de mamífero. Creemos que si seguimos lo mismo procedimiento probablemente podríamos resolver la estructura de la tirosinasa y la proteína 2 relacionada con la tirosinasa, por lo que estos resultados parecen muy prometedores en nuestra búsqueda para desenredar la compleja forma en que se genera la melanina ".
Los científicos también han revelado un resultado inesperado:han descubierto que TYRP1 necesita zinc para funcionar, contrario a la creencia establecida en la comunidad de que esta enzima necesita cobre. "Todavía no sabemos exactamente qué papel desempeña el zinc en la interacción con TYRP1 y necesitamos más investigaciones para averiguarlo", explica Montse Soler López, autor correspondiente del artículo y científico de la ESRF.

Montse Soler López, Autor correspondiente, Científico de ESRF en el laboratorio de ESRF. Crédito:@ESRF
La clave de este trabajo es que proporciona un verdadero modelo para el diseño de compuestos blanqueadores para eliminar las manchas que aparecen en la piel de las personas debido al sol o la edad. Bauke W. Dijkstra, también autor correspondiente y exdirector de investigación de la ESRF, explica la relevancia de su trabajo en el contexto industrial:"Las empresas cosméticas están invirtiendo un gran esfuerzo en esto, por lo que esperamos que nuestros hallazgos sean un gran avance en el campo ".