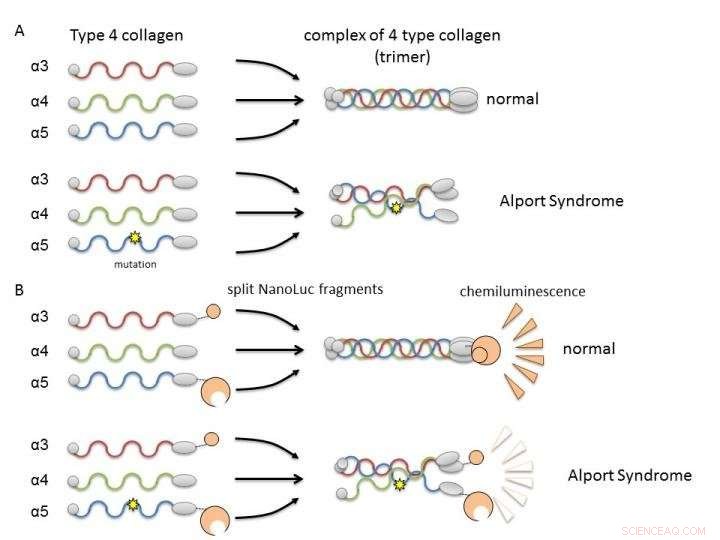
(A) Colágeno IV alfa-3, alfa-4, y alfa-5 normalmente forman complejos (trímeros) y se convierten en constituyentes de la membrana basal del riñón. En el síndrome de Alport, la mutación genética en una de las cadenas interrumpe la formación de trímeros. (B) Al fusionar cadenas de colágeno con fragmentos de nanoluciferasa, es posible evaluar la formación de trímeros de alfa-3, alfa-4, y alfa-5 por intensidad de luminiscencia. Crédito:Dr. Kohei Omachi
El síndrome de Alport (AS) es una enfermedad renal hereditaria causada por una mutación genética que conduce a anomalías del colágeno tipo IV (Col4). Desafortunadamente, El tratamiento mediante la corrección de la funcionalidad de Col4 aún no se ha desarrollado. Ahora, investigadores de la Universidad de Kumamoto en Japón han establecido una tecnología altamente sensible para evaluar la funcionalidad de Col4, allanando el camino hacia los medicamentos terapéuticos. Este sistema de detección reduce los costos de mano de obra y tiempo en comparación con los métodos convencionales, y monitorea la funcionalidad de Col4 con mayor sensibilidad que nunca. El sistema también permite analizar simultáneamente varios compuestos candidatos a fármacos.
Se ha descubierto que los inhibidores de la ECA y otros medicamentos para tratar la hipertensión retardan la progresión de la EA. Sin embargo, este tratamiento solo alivia los síntomas y no puede prevenir la transición a la insuficiencia renal en etapa terminal. Por tanto, se considera que el tratamiento fundamental debe centrarse en la causa de la aparición de la enfermedad, un enfoque que es completamente diferente de los métodos anteriores. La estrategia terapéutica, en este caso, se centraría en normalizar la función de la proteína causante con un fármaco candidato. Si tiene éxito, esta técnica contribuiría en gran medida al tratamiento de otras enfermedades hereditarias.
Para normalizar la función de la proteína causante con un fármaco candidato, es necesario cribar e identificar de manera eficiente compuestos que restauren la función comprometida por la mutación genética. Sin embargo, aún no se ha desarrollado un sistema de análisis para evaluar la funcionalidad de las proteínas causantes. Un sistema de este tipo podría usarse para seleccionar candidatos a fármacos terapéuticos. Por lo tanto, Los investigadores de la Universidad de Kumamoto se propusieron establecer un nuevo sistema de evaluación (un sistema de detección de compuestos) solo para ese propósito.
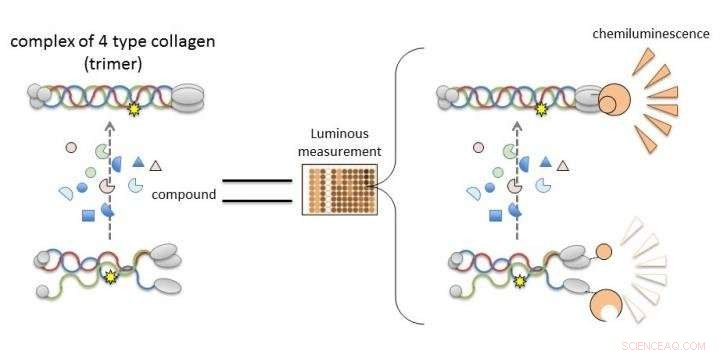
Colágeno IV alfa-3, alfa-4, y el alfa-5 en el síndrome de Alport no puede formar trímeros, por lo que el descubrimiento de compuestos que conducen o mejoran su formación conducirán al desarrollo de nuevas terapias. Un nuevo trabajo de la Universidad de Kumamoto permite evaluar la trimerización de las cadenas alfa del colágeno IV midiendo la luminiscencia. Es probable que los compuestos que inducen luminiscencia en el sistema NanoLuc-Col4 promuevan la trimerización. Crédito:Dr. Kohei Omachi
En Col4, tres cadenas polipeptídicas (proteínas en forma de varilla), alfa-3, alfa-4, y alpha-5, forman un complejo llamado trímero de proteínas. Este trímero es un factor constituyente de la membrana basal en la parte del riñón llamada glomérulo. La membrana basal glomerular es una barrera física contra la fuga de componentes sanguíneos durante la filtración de sangre. una función renal importante para la producción de orina. Una mutación en cualquiera de las tres cadenas polipeptídicas puede interrumpir la formación de trímeros y dar como resultado el desarrollo de AS debido a una falla en la formación adecuada de la membrana basal. Por lo tanto, es necesario buscar compuestos que puedan corregir o ayudar a la formación de trímeros por el colágeno mutante.
Los investigadores utilizaron NanoLuciferase dividido (NanoLuc dividido, Tecnología NanoBiT) para el análisis de la interacción proteína-proteína como método de evaluación de la formación de trímeros. Se fusionaron fragmentos de dos moléculas de luciferasa grandes y pequeñas con cadenas alfa-3 y alfa-5 y se expresaron en células con cadenas alfa-4. La luminiscencia medible se detectó solo cuando alfa-3, alfa-4, y las cadenas alfa-5 podrían formar trímeros.
Los investigadores aclararon que el sistema NanoLuc-Col4 refleja características previamente informadas de Col4, es decir, que los trímeros se forman con una combinación fija de alfa-3, alfa-4, y cadenas alfa-5, y que las cadenas alfa-5 no pueden formar trímeros si les falta una parte funcional. El sistema NanoLuc-Col4 también reveló que las cadenas alfa-5 con las mutaciones genéticas informadas en AS no funcionaron. En tono rimbombante, como prueba del principio de que es factible corregir la formación de trímeros para el colágeno mutante, los autores pudieron usar el sistema para identificar compuestos que pudieron inducir la formación de triméricos de alfa-3, colágeno alfa-4 y alfa-5 mutante.
"Esta investigación debería proporcionar una vía para desarrollar medicamentos para enfermedades hereditarias, como el síndrome de Alport, que actualmente son incurables, ", dijo el profesor Hirofumi Kai del Departamento de Medicina Molecular de la Universidad de Kumamoto.
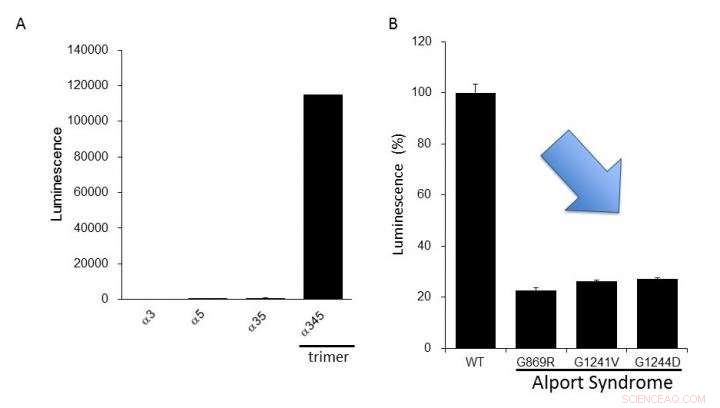
(A) Expresión de colágeno IV alfa-3, alfa-4, y alfa-5 en las células. Se produjo alta luminiscencia solo en la formación del trímero alfa-345. (B) Las proteínas alfa-5 mutantes informadas en el síndrome de Alport tenían una formación de trímero más baja que la del tipo normal (WT). Esto sugiere que podemos evaluar las anomalías funcionales del colágeno IV que se encuentran en el síndrome de Alport utilizando este sistema de ensayo. Crédito:Dr. Kohei Omachi