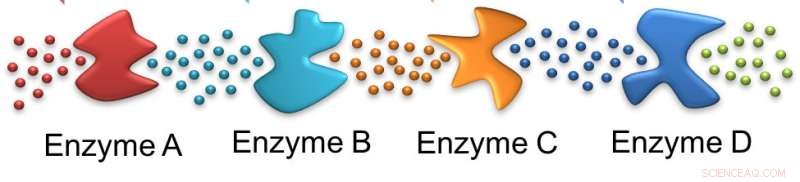
Como hormigas una enzima sigue el rastro dejado por la anterior. En este caso, el sustrato inicial es actuado por la enzima A, dejando un sustrato adecuado para la enzima B y en el futuro. Crédito:Ayusman Sen, Penn State
Una cucharada de azúcar puede hacer que el medicamento baje, pero comprender lo que le sucede a ese azúcar en la célula es mucho más complicado que la simple digestión, según los investigadores. Para que los azúcares se metabolicen y proporcionen energía a las células, una serie de enzimas - catalizadores biológicos - cada una, Sucesivamente, descomponer un reactivo. En este caso, los investigadores usaron glucosa, el azúcar que se encuentra en el jarabe de maíz y uno de los dos azúcares que resultan cuando el azúcar de mesa, la sacarosa, se descompone en el cuerpo.
En esta cascada la primera enzima actúa sobre la glucosa suministrada a la célula y las enzimas posteriores actúan sobre productos sucesivos. En el proceso, Se consumen dos moléculas de trifosfato de adenosina, ATP, pero se producen cuatro. La hidrólisis de ATP impulsa muchos procesos celulares para mantener la viabilidad celular. Cascadas de enzimas similares son responsables de muchos procesos metabólicos en el cuerpo.
En algunos casos se ha demostrado que las enzimas que participan en tales vías de reacción forman intracelulares, complejos reversibles denominados metabolones por Paul Srere (fallecido), Facultad de Medicina de la Universidad de Texas Southwestern. Tener las enzimas próximas unas a otras facilita la serie de reacciones que catalizan. Un ejemplo de ello es el purinosoma descubierto en el laboratorio del profesor de la Universidad Evan Pugh y cátedra Eberly de química Stephan J. Benkovic en Penn State, que consta de seis enzimas involucradas en la biosíntesis de purinas.
Los investigadores preguntaron si uno de los factores que contribuyen a la formación del metabolismo podría ser un gradiente de sustancias químicas generadas por las enzimas participantes. Informan sus resultados en la edición de hoy (18 de diciembre) de Química de la naturaleza .
"Descubrimos hace algún tiempo que las moléculas catalizadoras simples, como las enzimas, también quimiotaxizarán el gradiente de un reactivo, "dijo Ayusman Sen, distinguido profesor de química, Penn State. "Se mueven hacia concentraciones cada vez más altas de reactivo".
El movimiento se denomina quimiotaxis, donde las moléculas individuales migran a lo largo de un gradiente de concentración de otras moléculas.
"Todos los seres vivos quimiotax, "dijo el Senador." Si tiene hambre y de repente huele papas fritas, intentarás caminar hacia las patatas fritas. Si el olor disminuye, girarás al azar para tratar de encontrar la mayor concentración de moléculas de olor a patatas fritas hasta que estés en el mostrador de patatas fritas ".
En su estudio, los investigadores utilizaron solo las primeras cuatro enzimas de la vía glucolítica:hexoquinasa, isomerasa de fosfoglucosa, fosfofructoquinasa y aldolasa. Estos cuatro pasos realmente consumen ATP. Para estudiar el movimiento de las enzimas, los investigadores utilizaron marcado fluorescente de hexoquinasa y aldolasa, la primera y cuarta enzimas de la vía. Cada uno fue etiquetado con un tinte fluorescente diferente para poder seguir el movimiento de ambas enzimas.
Observaron tres casos:la reacción normal en la que la hexoquinasa fosforila la glucosa; la reacción de hexoquinasa con manosa, un azúcar que se une con más fuerza pero tiene una velocidad de reacción más lenta; y finalmente con L-glucosa, una forma de glucosa que no utiliza la hexoquinasa. La fosforilación requiere ATP. En presencia de fosfoglucosa isomerasa, la segunda enzima, y fosfofructoquinasa, la tercera enzima, se produce el reactivo de la aldolasa.
Los investigadores observaron que la aldolasa se mueve hacia la hexoquinasa en su experimento de flujo, revelando que la aldolasa quimiotáctica el gradiente de reactivo producido por el funcionamiento de las tres primeras enzimas en la vía. La quimiotaxis fue mayor con D-glucosa, menos con manosa y no observado con L-glucosa.
El modelado teórico del movimiento de la enzima predijo cualitativamente la extensión del movimiento de la enzima.
Los investigadores también analizaron si la quimiotaxis de enzimas ocurriría en un modelo de ambiente intracelular excepcionalmente abarrotado. Agregaron una sustancia de gran peso molecular para simular tal hacinamiento. La quimiotaxis todavía se produjo, pero a un ritmo más lento.
"La quimiotaxis a lo largo de un gradiente químico podría ser un factor en el ensamblaje de grupos de enzimas como metabolones, ", dijo Benkovic." Otros factores, como las interacciones no covalentes, se espera que contribuyan ".
La resolución del instrumento de investigación, sin embargo, fue insuficiente para demostrar en este caso que las cuatro enzimas se estaban ensamblando en un metabolón. Los investigadores observaron la formación de grandes agregados de enzimas, pero no pudo demostrar que fueran metabolones funcionales.