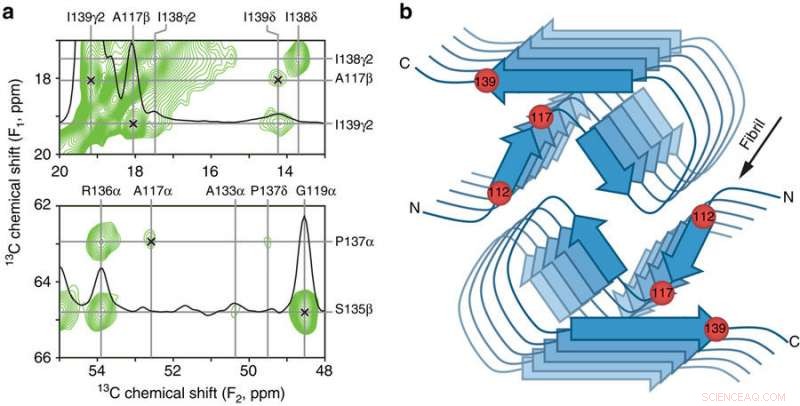
Contactos clave entre residuos y modelo esquemático del núcleo β amiloide PrP23-144 humano. a Pequeñas regiones de un espectro de RMN de estado sólido 13C-13C DARR bidimensional de 900 MHz registrado con un tiempo de mezcla de 500 ms para las fibrillas amiloides generadas a partir de huPrP23-144 expresado con 3-13C-piruvato como fuente de carbono. Las regiones espectrales contienen las restricciones clave en la estructura del núcleo de amiloide [hu] en forma de correlaciones inequívocas de largo alcance (indicadas por marcas x) entre los siguientes átomos de 13C:A117Cβ-I139Cγ2, A117Cβ-I139Cδ, A117Cα-P137Cα, y G119Cα-S135Cβ. b Modelo esquemático para el núcleo de amiloide [hu] basado en la combinación de datos de microscopía electrónica de transmisión de haz inclinado y RMN de estado sólido (consulte el texto para obtener más detalles). En este modelo, las fibrillas de amiloide [hu] consisten en dos protofilamentos en una disposición simétrica en C2 con regiones de hoja β que corren paralelas al eje largo de las fibrillas. Las ubicaciones aproximadas de los residuos de aminoácidos 112, 117, y 139, que tienen un gran impacto en la estructura adoptada por el amiloide PrP23-144 como se discute en el texto, están indicados por esferas rojas. Crédito: Comunicaciones de la naturaleza (2017). DOI:10.1038 / s41467-017-00794-z
Los investigadores que estudian una proteína que causa una enfermedad cerebral degenerativa hereditaria en humanos han descubierto que los humanos, formas de ratón y hámster de la proteína, que tienen secuencias de aminoácidos casi idénticas, exhiben distintas estructuras tridimensionales a nivel atómico.
La proteína causa angiopatía amiloide cerebral humana familiar (CAA), y el estudio, que aparece en Comunicaciones de la naturaleza , es el primero en examinar formas de la proteína en tres especies diferentes.
Christopher Jaroniec, profesor de química y bioquímica en la Universidad Estatal de Ohio, dijo que los hallazgos resaltan el hecho de que alteraciones menores en un solo aminoácido pueden causar profundas diferencias en la estructura y función entre esta familia de proteínas.
"Las diferencias a gran escala en las estructuras y características de transmisión de estas proteínas, causadas por diferencias aparentemente insignificantes en las posiciones de algunos átomos de carbono e hidrógeno, son bastante notables, "Dijo Jaroniec.
El estudio no constituye la base para una nueva prueba o tratamiento para la AAC, sino que utiliza estas proteínas como modelos para comprender los aspectos fundamentales de la transmisión entre especies de toda una clase de enfermedades cerebrales degenerativas conocidas como enfermedades priónicas, él explicó. También subraya la utilidad de la espectroscopia de resonancia magnética nuclear (RMN) de estado sólido para obtener imágenes de las estructuras de proteínas asociadas con enfermedades priónicas.
Los investigadores saben que en el cuerpo, las moléculas de proteína asociadas con CAA forman placas que se alojan en las paredes de los vasos sanguíneos del cerebro, pero no ha habido exámenes detallados de la estructura molecular de estas placas hasta hace poco. En 2008, Los investigadores del estado de Ohio y sus socios en la Case Western Reserve University realizaron los estudios iniciales de estado sólido de la variante de proteína priónica relevante, y redujo la lista de aminoácidos posiblemente críticos para su función a aproximadamente 30.
Ahora, han demostrado que un solo aminoácido, conocido por su número a lo largo de la cadena de proteínas, 139:es la clave para que esta variante de la proteína priónica adopte una estructura "similar a la humana" frente a una estructura "similar a la de un hámster", mientras que otro aminoácido, 112, rige las diferencias estructurales entre las versiones humana y de ratón de la proteína. También han demostrado que estos dos aminoácidos parecen ser responsables de la aparición de "cepas de priones" estructuralmente distintas dentro de la misma secuencia de proteínas. en analogía con distintas cepas de un virus.
Las enfermedades priónicas más conocidas incluyen la encefalopatía espongiforme bovina (a menudo llamada "enfermedad de las vacas locas") y la enfermedad de Creutzfeldt-Jakob en humanos. Todos son incurables y fatales, y algunos también pueden ser transmisibles. Se cree que las estructuras que adoptan las proteínas priónicas del cerebro dentro de las placas son críticas para su capacidad de transmitirse entre diferentes huéspedes y causar enfermedades.
"Nuestro grupo está trabajando actualmente en la determinación de las estructuras moleculares de alta resolución de las variantes de proteínas priónicas truncadas asociadas con la AAC humana familiar con el fin de obtener una comprensión atomística completa de los factores subyacentes a su transmisión". y el presente estudio es un trampolín importante en este esfuerzo, "Dijo Jaroniec.
"Esperamos que algún día nuestro grupo y otros investigadores puedan utilizar metodologías similares para desentrañar la base estructural de las enfermedades priónicas transmisibles". "añadió.