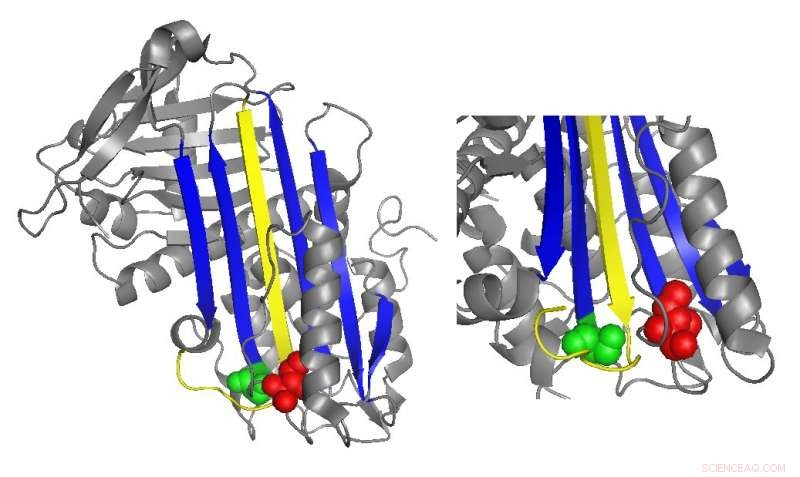
Un diagrama de cinta de antitrombina destaca las ubicaciones de mutaciones funcionalmente importantes. Crédito:Irene Martinez-Martinez
Cuando una persona se lesiona, la coagulación de la sangre es fundamental. Sin embargo, una vez pasado el peligro, es igualmente esencial detener la respuesta de la coagulación para prevenir la trombosis, o la obstrucción del flujo sanguíneo por coágulos. Una proteína llamada antitrombina es responsable de detener la coagulación, pero aproximadamente una de cada dos mil personas tiene una deficiencia hereditaria de antitrombina que las pone en un riesgo mucho mayor de coágulos sanguíneos potencialmente mortales.
Un grupo de investigadores en España ha analizado las mutaciones en las proteínas antitrombina de estos pacientes y ha descubierto que una sección de la proteína juega un papel inesperado en su función. Esta información sobre cómo funciona la antitrombina podría conducir a tratamientos no solo para pacientes con deficiencia de antitrombina, sino también a medicamentos mejor diseñados para otros trastornos sanguíneos. La investigación se publicará en la edición del 6 de octubre de la Revista de química biológica .
El Centro Regional de Hemodonación y Hospital Universitario Morales Meseguer de la Universidad de Murcia en España es un centro de referencia para el diagnóstico de deficiencia de antitrombina. Durante más de 15 años, Los investigadores del laboratorio han estado recibiendo muestras de pacientes con diversas mutaciones que afectan el funcionamiento de su antitrombina.
La antitrombina normalmente inhibe la trombina insertando una región en forma de bucle, llamado bucle del centro reactivo, en el sitio activo de la proteína trombina, evitar que la trombina catalice la formación de coágulos distorsionando la forma del sitio activo de la trombina. Muchas mutaciones de antitrombina que causan enfermedades de la coagulación afectan directa o indirectamente al asa del centro reactivo. Sin embargo, Los estudios bioquímicos dirigidos por Irene Martinez-Martinez descubrieron que las mutaciones en una parte completamente diferente de la antitrombina también contribuían a su disfunción.
“Vimos que [teníamos] mutantes que estaban afectando la función de la proteína a pesar de que estaban muy lejos de la parte principal de la proteína que está a cargo de la inhibición, "Dijo Martínez-Martínez." La gente pensaba que la función de la antitrombina se concentraba principalmente en un dominio de la proteína. Con este trabajo nos hemos dado cuenta de que eso no es cierto ".
Los análisis de los investigadores de las nuevas mutaciones sugirieron que el dominio de la antitrombina en el extremo opuesto del bucle del centro reactivo ayuda a mantener la trombina atrapada en su punto final. forma distorsionada. Cuando hubo mutaciones específicas en esta región, la trombina fue más a menudo capaz de volver a su forma activa y degradar y liberar la antitrombina.
Martínez-Martínez espera que comprender la importancia de esta región de la antitrombina pueda conducir a mejores medicamentos para prevenir la coagulación de la sangre activando la antitrombina o previniendo el sangrado inhibiéndola. También enfatiza que la naturaleza esencial de este dominio de la proteína no podría haberse predicho simplemente estudiando las secuencias de antitrombinas saludables.
"Este trabajo ha sido posible gracias a la caracterización de mutaciones identificadas en pacientes, "Dijo Martínez-Martínez.
El trabajo fue financiado por las fundaciones Instituto de Salud Carlos III y FEDER así como por la Fundación Séneca.