Crédito:Instituto de Química Bioorgánica de la Academia de Ciencias de Rusia
Los científicos rusos informan que la enzima fosfolipasa A2 del veneno de Vipera nikolskii puede adherirse a las membranas lipídicas y causar su agregación. incluso si la actividad de la enzima está específicamente bloqueada. Esto se debe a la presencia de dos sitios de unión en la estructura de la enzima. Publicado en la revista Toxicon , los resultados ayudan a comprender cómo funcionan los venenos de serpientes multicomponente.
Algunos animales evitan el peligro con ayuda del camuflaje, otros con garras, dientes o pezuñas. Y algunos insectos arañas los escorpiones y las serpientes tienen venenos que no solo pueden paralizar, pero también mata al atacante. Muchos investigadores están interesados en los complejos componentes del veneno, porque pueden utilizarse para producir antídotos y crear nuevos fármacos. Los venenos contienen neurotoxinas, venenos que actúan sobre el sistema nervioso y bloquean la conducción de los impulsos nerviosos. Estas neurotoxinas incluyen ciertos tipos de enzima fosfolipasa A2.
El interés de los investigadores por la fosfolipasa A2 se debe al hecho de que sirve como marcador de inflamación. Esto significa que el nivel de esta enzima en la sangre aumenta con una inflamación aguda en el cuerpo. Por lo tanto, varios grupos científicos internacionales están intentando crear sistemas para detectar la actividad de la fosfolipasa A2.
En 2016, Los investigadores del Laboratorio de Química de Lípidos de IBCh RAS han desarrollado un método de fluorescencia fundamentalmente nuevo para detectar la interacción de esta enzima con una doble capa molecular de lípidos (la llamada bicapa lipídica), la estructura básica de la membrana celular. El método se basa en la transferencia de energía entre dos tintes fluorescentes (fluoróforos unidos a las moléculas de fosfolípidos) incrustados en la bicapa lipídica.
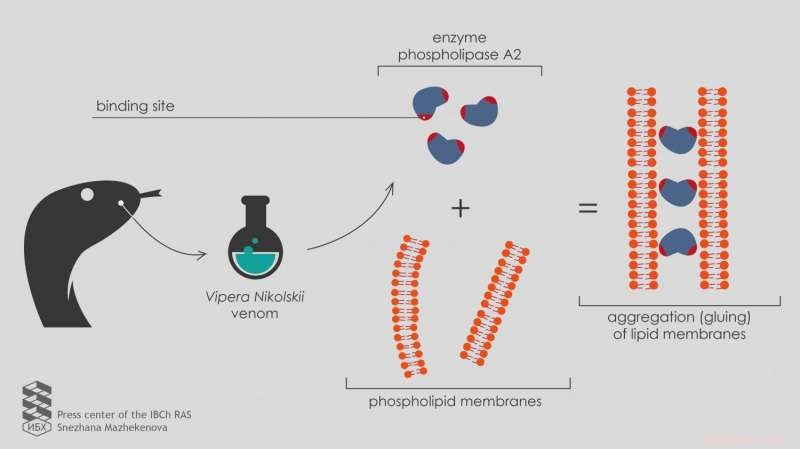
"Para probar el nuevo desarrollo en tantas muestras como sea posible, nos dirigimos al Laboratorio de Toxinología Molecular IBCh RAS, "dice Ivan Boldyrev, investigador senior en el Laboratorio de Química de Lípidos. "El jefe del laboratorio, Yuri Utkin, ha recogido un conjunto de fosfolipasas A2 de venenos de varios organismos, incluyendo dos fosfolipasas A2 heterodiméricas del veneno de Vipera nikolskii. Cada una de estas enzimas consta de dos subunidades heterofuncionales, cadenas polipeptídicas plegadas de una manera específica. Sin embargo, el mecanismo del efecto tóxico de estos heterodímeros no está claro ".
La investigación produjo resultados inesperados. Bajo la acción de estas "proteínas dobles" (heterodímeros), no se produjo fluorescencia, como con todas las demás fosfolipasas, pero en cambio decayó.
Un estudio más en profundidad utilizando microscopía electrónica mostró que las fosfolipasas heterodiméricas A2 del veneno de Vipera nikolskii causaron la agregación de las membranas lipídicas, lo que significa que los pegan juntos. Sin embargo, este efecto surgió solo con membranas cargadas negativamente.
"Las membranas sin carga y sin carga eléctrica en la superficie no se combinan bajo la acción de heterodímeros, "explica Anna Alekseeva, investigador junior en el Laboratorio de Química de Lípidos.
“Logramos establecer la especificidad de las fosfolipasas heterodiméricas A2 para membranas cargadas negativamente y determinamos las condiciones de pH del medio en el que se manifiesta la enzima, "dice DariaTretyakova, un doctorado estudiante del Laboratorio de Química de Lípidos.
Los nuevos datos ayudarán a comprender el efecto de los venenos de serpientes multicomponente, y la metodología desarrollada estará en demanda para estudiar otras interacciones lípido-proteína.