Los antibióticos se convirtieron en un tratamiento popular para las infecciones bacterianas a principios del siglo XX y surgieron como una herramienta transformadora en la salud humana. A mediados de siglo, se desarrollaron periódicamente nuevos antibióticos en la época dorada de la medicación.
Pero luego evolucionaron las bacterias. Encontraron nuevas formas de evadir los tratamientos con antibióticos, inutilizando muchos de ellos. A medida que se agotaron las nuevas fuentes de antibióticos, las infecciones bacterianas se intensificaron hasta convertirse en la actual crisis sanitaria mundial de resistencia a los antibióticos.
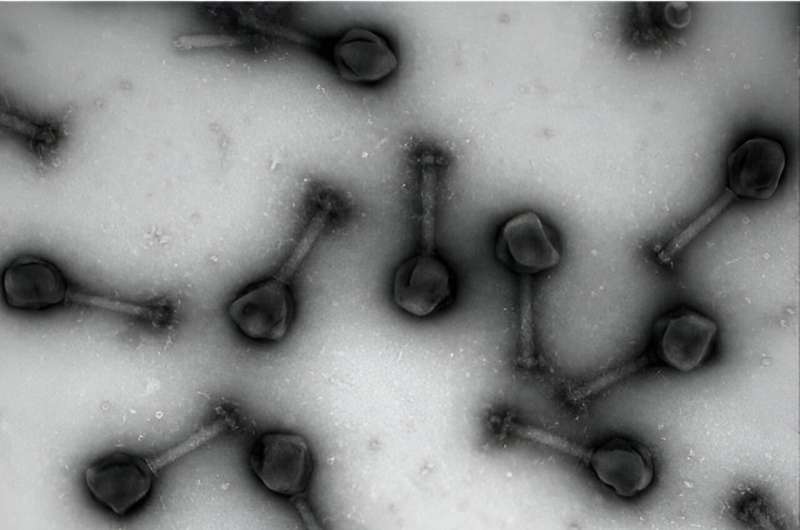
Los científicos ahora buscan un aliado inusual, los virus, para ayudar a contrarrestar esta creciente amenaza. Recientemente, los investigadores se han centrado en los virus conocidos como bacteriófagos como una nueva herramienta para tratar y desarmar las bacterias resistentes a los antibióticos. Se ha prestado especial atención a los fagos "jumbo" (virus que recientemente se descubrió que presentan genomas extremadamente grandes) que podrían aprovecharse como agentes de administración especiales que no sólo pueden matar bacterias sino que también podrían diseñarse para administrar antibióticos directamente a la fuente de infección. P>
Pero para poder ofrecer terapias novedosas a través de fagos, los científicos primero deben comprender la extraordinaria composición biológica y los mecanismos internos de estos misteriosos virus.
Investigadores de la Facultad de Ciencias Biológicas de la Universidad de California en San Diego y sus colegas del Instituto de Genómica Innovadora de la UC Berkeley y la Universidad Chulalongkorn de Bangkok han dado un importante paso adelante en el desciframiento de varias funciones clave dentro de los fagos gigantes.
"Estos fagos gigantes tienen genomas grandes que, en teoría, podrían manipularse para transportar cargas útiles que maten las bacterias de manera más efectiva", dijo Joe Pogliano, profesor de la Facultad de Ciencias Biológicas de UC San Diego y autor principal de un nuevo artículo publicado en Actas de la Academia Nacional de Ciencias . "El problema es que su genoma está cerrado, por lo que no es fácil acceder a él. Pero ahora hemos descubierto algunos de sus elementos clave".
Como se describe en el artículo, la investigación dirigida por el estudiante graduado de la Facultad de Ciencias Biológicas Chase Morgan se centró en fagos gigantes de Chimalliviridae que se replicaban dentro de las bacterias formando un compartimento que se asemeja al núcleo dentro de las células de los humanos y otros organismos vivos. El compartimento similar a un núcleo de Chimalliviridae separa e importa selectivamente ciertas proteínas que le permiten replicarse dentro de la bacteria huésped. Pero cómo se desarrolla este proceso ha sido una parte desconcertante del mismo.
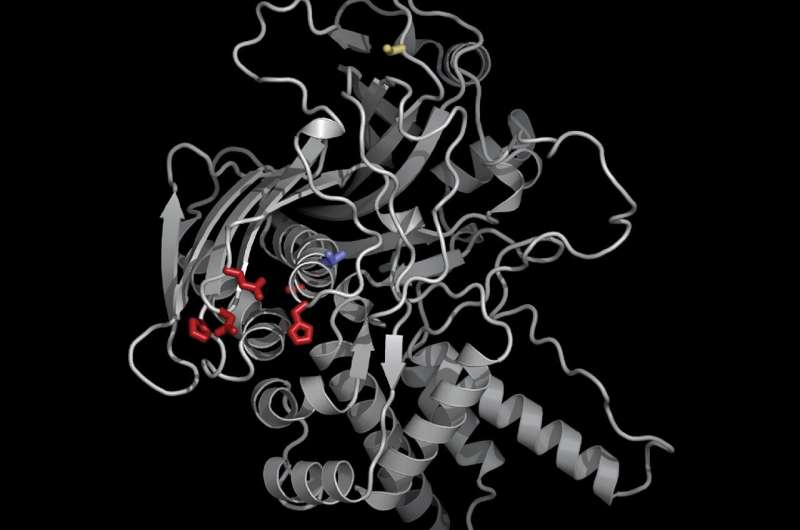
Utilizando nuevas herramientas genéticas y de biología celular, Morgan y sus colegas identificaron una proteína clave, a la que denominaron "importadora de proteínas de Chimallivirus A" o PicA, que actúa como una especie de portero de club nocturno, traficando proteínas selectivamente al permitir la entrada al núcleo para algunos pero negando el acceso a otros. Descubrieron que PicA coordina el tráfico de proteínas de carga a través de la capa protectora del núcleo del fago.
"El solo hecho de que este virus sea capaz de establecer esta estructura y sistema de transporte increíblemente complejos es realmente sorprendente y no lo hemos visto antes", dijo Morgan. "Lo que consideramos biología compleja generalmente se reserva para formas de vida superiores con humanos y nuestras decenas de miles de genes, pero aquí estamos viendo procesos funcionalmente análogos en un genoma viral comparativamente pequeño de sólo aproximadamente 300 genes. Es probablemente el método selectivo más simple. sistema de transporte que conocemos."
Utilizando CRISPRi-ART, una herramienta de ARN programable para estudiar genomas, los investigadores pudieron demostrar que PicA es un componente esencial del proceso de desarrollo y replicación del núcleo de Chimalliviridae.
"Sin la simplicidad y versatilidad de las tecnologías CRISPR dirigidas al ARN, formular y responder directamente estas preguntas sería casi imposible. Estamos muy emocionados de ver cómo estas herramientas desentrañan los misterios codificados por los genomas de los fagos", dijo el coautor Ben Adler, un Académico postdoctoral que trabaja con la pionera de CRISPR, ganadora del Premio Nobel, Jennifer Doudna.
Las bacterias y los virus han participado en una especie de carrera armamentista durante miles de millones de años, y cada uno de ellos ha evolucionado para contrarrestar las adaptaciones del otro. Los investigadores dicen que el sofisticado sistema de transporte PicA es el resultado de esa intensa y continua competencia evolutiva. El sistema ha evolucionado para ser a la vez altamente flexible y altamente selectivo, permitiendo sólo elementos beneficiosos clave dentro del núcleo. Sin el sistema PicA, las proteínas defensivas de las bacterias se abrirían camino hacia el interior y sabotearían el proceso de replicación del virus.
Esta información es vital mientras los científicos de la Iniciativa de Patógenos Emergentes y el Centro de Terapéuticas y Aplicaciones Innovadoras de Fagos de UC San Diego se esfuerzan por sentar las bases para eventualmente programar genéticamente fagos para tratar una variedad de enfermedades mortales.
"Realmente no entendíamos cómo funcionaba el sistema de importación de proteínas o qué proteínas estaban involucradas anteriormente, por lo que esta investigación es el primer paso para comprender un proceso clave que es fundamental para que estos fagos se repliquen con éxito", dijo la Facultad de Ciencias Biológicas. la estudiante de posgrado Emily Armbruster, coautora del artículo. "Cuanto más comprendamos estos sistemas esenciales, mejor podremos diseñar fagos para uso terapéutico".
Los objetivos futuros de estos virus genéticamente programados incluyen la bacteria Pseudomonas aeruginosa, que se sabe que causa infecciones potencialmente mortales y plantea riesgos para los pacientes hospitalizados. Otros objetivos prometedores incluyen E. coli y Klebsiella, que pueden causar infecciones crónicas y recurrentes y, en algunos casos, ingresar al torrente sanguíneo, lo que puede poner en peligro la vida.
Más información: Chase J. Morgan et al, Una vía de importación de proteínas esencial y altamente selectiva codificada por fagos formadores de núcleos, Actas de la Academia Nacional de Ciencias (2024). DOI:10.1073/pnas.2321190121
Información de la revista: Actas de la Academia Nacional de Ciencias
Proporcionado por la Universidad de California - San Diego