Un equipo de investigación conjunto dirigido por el Dr. Akira Kunitomi, ex becario postdoctoral en CiRA (actualmente investigador en el Instituto Gladstone de Enfermedades Cardiovasculares), e ID Pharma Co., Ltd., ha descubierto el papel crucial de la histona enlazadora específica de ovocitos. , H1FOO, para mejorar la eficiencia y la homogeneidad de la reprogramación en estados pluripotentes preparados e ingenuos. El estudio se publica en Stem Cell Reports .
Mientras que la reprogramación convencional produce células madre pluripotentes inducidas (iPS) humanas con características "preparadas", que se asemejan a epiblastos postimplantación con potencial limitado para convertirse en tejidos extraembrionarios, el estado pluripotente "ingenuo" muestra propiedades más similares a las células epiblásticas previas a la implantación y a las células iPS de ratón. , permitiéndoles así diferenciarse en linajes embrionarios y extraembrionarios.
Aunque las células iPS humanas preparadas e ingenuas han permitido avances biomédicos antes inimaginables, un desafío principal relacionado con las células iPS para la investigación básica y con fines médicos es su heterogeneidad. Los métodos de reprogramación tradicionales siguen siendo un proceso estocástico y, por lo tanto, muchos investigadores continúan buscando medios más eficientes y precisos para generar células iPS homogéneas.
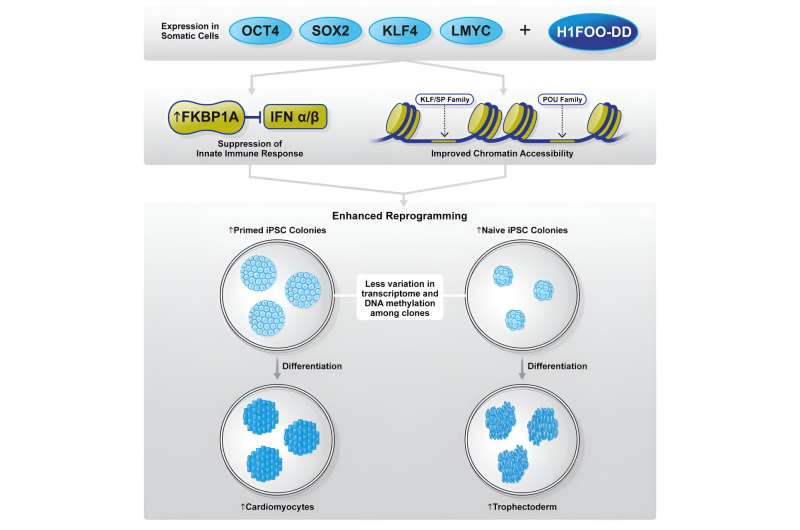
En su estudio reciente, el equipo de investigación colaborativo examinó el potencial de la histona enlazadora específica materna H1FOO como factor candidato para refinar el proceso de reprogramación. Los investigadores diseñaron H1FOO adjuntándole un dominio de desestabilización (DD) para poder manipular su degradación químicamente y regular cuidadosamente sus niveles.
Cuando se usó en combinación con los factores de Yamanaka (OSKL, MYC fue reemplazado por LMYC para evitar la tumorigénesis), descubrieron que H1FOO-DD mejoraba significativamente la eficiencia de generación de células iPS, independientemente del sistema de administración de genes utilizado.
Aunque la expresión genética y los análisis epigenéticos no identificaron ninguna diferencia significativa entre la reprogramación usando solo OSKL o en combinación con H1FOO-DD, sí revelaron que al usar H1FOO-DD, las células iPS generadas de forma independiente mostraron un patrón de expresión genética más similar. , lo que indica mejoras en la homogeneidad y reproducibilidad.
En particular, un análisis de genes con expresión muy variable entre líneas celulares iPS independientes sugirió que H1FOO redujo dicha variabilidad a casi la mitad. Fundamentalmente, muchos de estos genes están involucrados en la regulación de la expresión genética, lo que demuestra la capacidad de H1FOO-DD para guiar el proceso de reprogramación de manera más estricta.
Además, los investigadores también observaron que las células iPS generadas mediante reprogramación con H1FOO-DD eran mejores para diferenciarse en endodermo, una de las tres capas germinales primarias, y cardiomiocitos (un tipo de célula mesodérmica).
El equipo de investigación continuó su investigación examinando los mecanismos subyacentes a través de los cuales H1FOO-DD mejora la reprogramación. Mediante un análisis de secuenciación de ARN unicelular (scRNA-seq), los investigadores descubrieron que la reprogramación con H1FOO-DD no solo conducía a una expresión más temprana y mayor de genes relacionados con la pluripotencia, sino que también suprimía la expresión de genes relacionados con la respuesta inmune innata, la inflamación y apoptosis (muerte celular programada).
En particular, H1FOO-DD aumentó la proporción de células categorizadas como reprogramadas con éxito, al tiempo que redujo las subpoblaciones de células que se consideraba que habían sufrido una reprogramación incompleta o sin éxito.
Dado el papel del H1FOO como factor de remodelación de la cromatina, los investigadores también examinaron la accesibilidad a las regiones de la cromatina. De acuerdo con los hallazgos del análisis de expresión genética, las regiones de cromatina, especialmente aquellos marcadores de pluripotencia cercanos, se abrieron antes y fueron más accesibles cuando se incluyó H1FOO-DD como factor de reprogramación.
Un análisis más detallado demostró que las familias de factores de transcripción POU y KLF/SP se activaron antes durante el proceso de reprogramación por H1FOO-DD. Estos resultados sugieren que H1FOO-DD ayuda a coordinar la reprogramación de manera más eficiente y oportuna para mejorar la generación de células iPS.
A continuación, los investigadores se centraron en los efectores posteriores que ayudan a mediar los efectos positivos de H1FOO-DD en la generación de células iPS mediante el examen de genes con expresión diferencial en las primeras etapas de la reprogramación. A través de este análisis, identificaron 19 genes regulados positivamente y dos genes regulados negativamente cuando se incluyó H1FOO-DD como factor de reprogramación.
El equipo de investigación examinó estos genes individualmente para determinar si influyen en la reprogramación preparada e ingenua y descubrió que la sobreexpresión de FKBP1A o APOE mejora la reprogramación. Dado que anteriormente se informó que APOE se expresaba altamente durante la reprogramación, los investigadores centraron su atención en FKBP1A con la esperanza de revelar nuevos mecanismos moleculares subyacentes a una reprogramación exitosa.
En particular, descubrieron que, si bien la reprogramación utilizando OSKL solo aumenta la expresión de FKBP1A, la inclusión de H1FOO-DD la mejora drásticamente. Esta observación se vio respaldada aún más al reexaminar los datos de expresión genética y accesibilidad de la cromatina que ya habían recopilado.
FKBP1A es una inmunofilina implicada en la inmunosupresión que puede interactuar e inhibir el TGFBR1, lo que, a su vez, promueve la transición mesenquimal a epitelial (MET) y mejora la eficiencia de la reprogramación.
Por lo tanto, los investigadores plantearon la hipótesis de que ambas funciones de FKBP1A en la supresión de la inmunidad innata y la inhibición de MET mediada por TGFBR1 son probablemente responsables de la mejora de la eficiencia de reprogramación por parte de H1FOO-DD.
En particular, descubrieron que la reprogramación mediante una combinación de sobreexpresión de OSKL y FKBP1A conducía a una supresión de TGFBR1, mejora de MET, supresión de la respuesta inmune innata y apoptosis comparables, como cuando se usó H1FOO-DD para iniciar la reprogramación.
Por último, debido a que un análisis de expresión genética anterior indicó que además de mejorar la reprogramación preparada, H1FOO-DD también indujo la expresión de marcadores del estado ingenuo, los investigadores examinaron si H1FOO-DD también es capaz de promover la reprogramación al estado ingenuo. De hecho, observaron que la inclusión de H1FOO-DD mejoraba sustancialmente la generación de células iPS ingenuas.
Además, de manera análoga a la reprogramación preparada, H1FOO-DD reforzó el proceso de reprogramación al coordinar una regulación genética y epigenética más uniforme en las células. Funcionalmente, medido por la actividad metabólica y la reactivación del cromosoma X, la reprogramación usando H1FOO-DD produjo células iPS vírgenes más similares a las células madre embrionarias vírgenes o a los blastocistos previos a la implantación que cuando se usó OSKL solo.
En resumen, los esfuerzos combinados del equipo de investigación conjunto identificaron el eje H1FOO-FKBP1A como un medio para reprogramar células con mayor eficiencia y precisión. Estos hallazgos demostrarán tener un tremendo impacto en la generación de células iPS tanto para la investigación científica básica como para aplicaciones clínicas.
Más información: Akira Kunitomi et al, H1FOO-DD promueve la eficiencia y la uniformidad en la reprogramación hacia la pluripotencia ingenua, Stem Cell Reports (2024). DOI:10.1016/j.stemcr.2024.04.005
Información de la revista: Informes sobre células madre
Proporcionado por la Universidad de Kyoto