Una nueva investigación ha descubierto que algunas proteínas cambian de forma cuando se exponen a diferentes temperaturas, lo que revela sitios de unión de medicamentos previamente desconocidos.
Los hallazgos, publicados en Nature , podría revolucionar amplios sectores de la biología al cambiar fundamentalmente la forma en que se estudia y aprovecha la estructura de las proteínas para el diseño de fármacos. El estudio fue dirigido por Juan Du, Ph.D., y Wei Lü, Ph.D., del Instituto Van Andel.
Las proteínas generalmente se investigan a bajas temperaturas para garantizar su estabilidad. Sin embargo, el nuevo estudio demuestra que ciertas proteínas son muy sensibles a la temperatura y cambian de forma cuando se observan a la temperatura corporal.
"Durante mucho tiempo, los métodos que hemos utilizado para estudiar las proteínas requieren que estén frías o congeladas. Pero en el mundo real, las proteínas humanas existen y funcionan a la temperatura corporal", dijo Du. "Nuestro estudio describe una nueva forma de estudiar las proteínas a temperatura corporal y revela que algunas proteínas alteran drásticamente sus estructuras cuando se calientan, abriendo nuevas oportunidades para el desarrollo de fármacos guiados por la estructura".
Las proteínas son los caballos de batalla moleculares del cuerpo. Su forma gobierna cómo interactúan con otras moléculas para realizar su trabajo. Al determinar la estructura de las proteínas, los científicos pueden crear planos que guíen el desarrollo de medicamentos más eficaces, de forma muy parecida a como los cerrajeros diseñan llaves para encajar en cerraduras específicas.
Aunque es bien sabido que la temperatura afecta la función molecular del cuerpo, estudiar las proteínas a temperatura fisiológica ha sido un desafío tecnológico. El estudio de los laboratorios Du y Lü detalla cómo superaron estos problemas y proporciona a los científicos una hoja de ruta para hacerlo en sus propios experimentos.
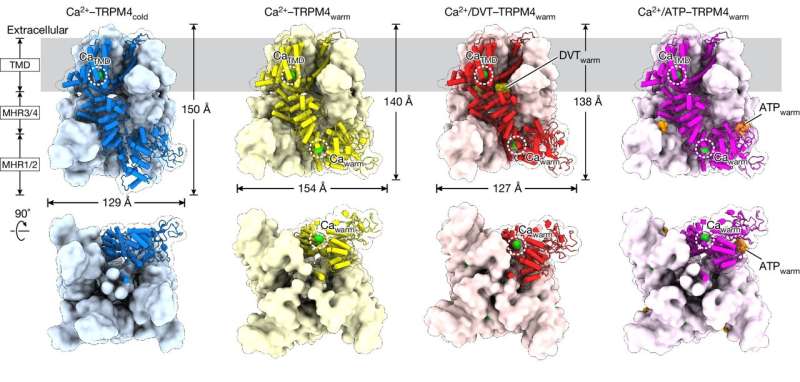
El estudio se centró en una proteína llamada TRPM4, que favorece la función y el metabolismo del corazón, incluida la liberación de insulina. Como tal, TRPM4 está relacionado con accidentes cerebrovasculares, enfermedades cardíacas y diabetes, entre otras afecciones de salud.
Para visualizar TRPM4 a temperatura corporal, el equipo aprovechó el potente conjunto de microscopios crioelectrónicos (cryo-EM) de VAI, que permiten a los científicos congelar rápidamente proteínas y ensamblar imágenes detalladas de sus estructuras. En lugar de utilizar una muestra de baja temperatura, el becario postdoctoral Jinhong Hu, Ph.D., y sus colegas de los laboratorios Du y Lü calentaron la muestra a la temperatura corporal antes de congelarla instantáneamente. Al hacerlo, descubrieron que los ligandos (moléculas que se unen a las proteínas) interactúan con sitios totalmente diferentes en TRPM4 a temperatura corporal que a temperaturas más bajas.
Las implicaciones del estudio de hoy son de gran alcance y refuerzan la importancia de estudiar las proteínas a temperatura corporal para garantizar la identificación de sitios de unión de fármacos fisiológicamente relevantes.
Otros autores incluyen a Sung Jin Park, Ph.D., Tyler Walter, Ph.D., Ian J. Orozco, Ph.D., Garrett O'Dea y Xinyu Ye de VAI. Los datos crio-EM se recopilaron en Cryo-EM Core de VAI y en David Van Andel Cryo-Electron Microscopy Suite.
Más información: Jinhong Hu et al, La temperatura fisiológica impulsa el reconocimiento y la activación del ligando TRPM4, Naturaleza (2024). DOI:10.1038/s41586-024-07436-7
Información de la revista: Naturaleza
Proporcionado por el Instituto de Investigación Van Andel