Una estrategia simple y sólida desarrollada por los científicos de KAUST podría ayudar a mejorar la seguridad y precisión de la edición de genes CRISPR, una herramienta que ya está aprobada para uso clínico en el tratamiento de trastornos sanguíneos hereditarios.
Este enfoque aborda un problema crítico con la tecnología CRISPR:el acto de cortar el genoma en puntos específicos y luego volver a unirlo, lo que inherentemente corre el riesgo de dañar el ADN de una manera que podría causar alteraciones impredecibles y a gran escala.
Con la esperanza de mitigar este problema, un equipo dirigido por Mo Li, biólogo de células madre de KAUST, investigó las vías de reparación del ADN que conducen a grandes deleciones genómicas después de la edición CRISPR en células madre humanas. El estudio se publica en la revista BMC Biology. .
Su análisis los llevó a un proceso conocido como unión de extremos mediada por microhomología (MMEJ), un mecanismo propenso a errores que, aunque es capaz de reparar roturas en el ADN, a menudo deja grandes eliminaciones a su paso.
Los investigadores interrogaron varios genes implicados en este proceso MMEJ y encontraron dos que desempeñaron papeles centrales, pero opuestos, en estos eventos de eliminación no deseados.
Un gen, llamado POLQ, resultó exacerbar el riesgo de grandes eliminaciones después de la edición CRISPR. El otro, llamado RPA, surgió como un guardián genómico con efectos protectores.
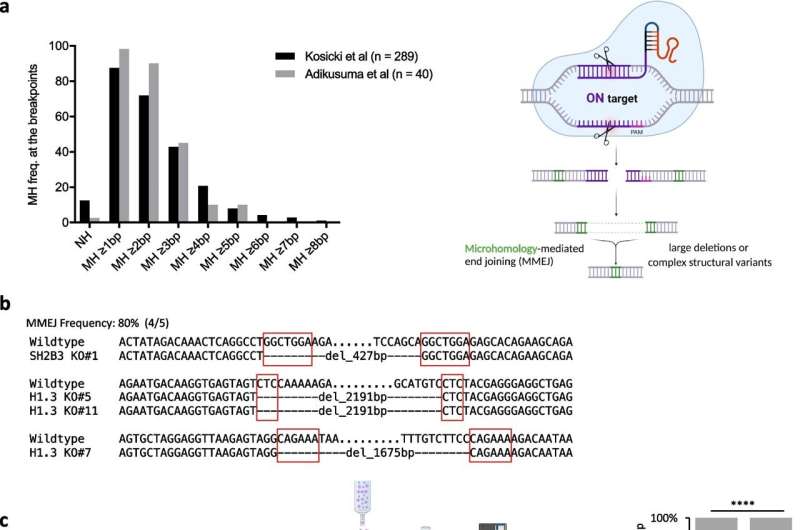
Al manipular estos genes, ya sea con fármacos que inhiben POLQ o mediante técnicas genéticas que estimulan la expresión de RPA, el equipo de KAUST pudo reducir la aparición de grandes eliminaciones perjudiciales sin comprometer la eficiencia de la edición del genoma y, al hacerlo, preservar la integridad genómica de las células madre editadas.
"Este enfoque fácil de usar podría reducir las posibilidades de que se produzcan estas grandes eliminaciones dañinas de ADN", dice Baolei Yuan, ex doctor. estudiante en el laboratorio de Li y uno de los arquitectos del estudio, junto con Chongwei Bi y Yeteng Tian del laboratorio de Li.
Además, se descubrió que estas mismas intervenciones mejoran la eficiencia de la reparación dirigida por homología, un mecanismo conocido por su capacidad para permitir la edición precisa del genoma sin agregar mutaciones no deseadas.
Esto fue evidente en experimentos con células madre que portaban mutaciones en dos genes relacionados con la anemia falciforme y el síndrome de Wiskott-Aldrich, ambos trastornos sanguíneos hereditarios. Al modular POLQ o RPA, los investigadores lograron una edición genética altamente precisa y confiable en estas células.
Los hallazgos marcan un importante paso adelante en el perfeccionamiento de la tecnología CRISPR, afirma Li. "Es realmente emocionante porque significa que nos estamos acercando a tratamientos más seguros y eficaces para las enfermedades genéticas", afirma.
Con una solicitud de patente provisional presentada para esta estrategia innovadora, el equipo continúa explorando los mecanismos detrás de una gama más amplia de mutaciones indeseables y perfeccionando sus técnicas para hacer que CRISPR sea más seguro y eficiente.
"Lograr una alta eficiencia y seguridad sigue siendo un desafío que requiere mayor desarrollo", afirma Li, "y nuestro laboratorio permanece a la vanguardia, buscando soluciones novedosas".
Más información: Baolei Yuan et al, La modulación de la vía de unión de extremos mediada por microhomología suprime las deleciones grandes y mejora la reparación dirigida por homología después de roturas del ADN inducidas por CRISPR-Cas9, BMC Biology (2024). DOI:10.1186/s12915-024-01896-z
Información de la revista: Biología de BMC
Proporcionado por la Universidad de Ciencia y Tecnología Rey Abdullah