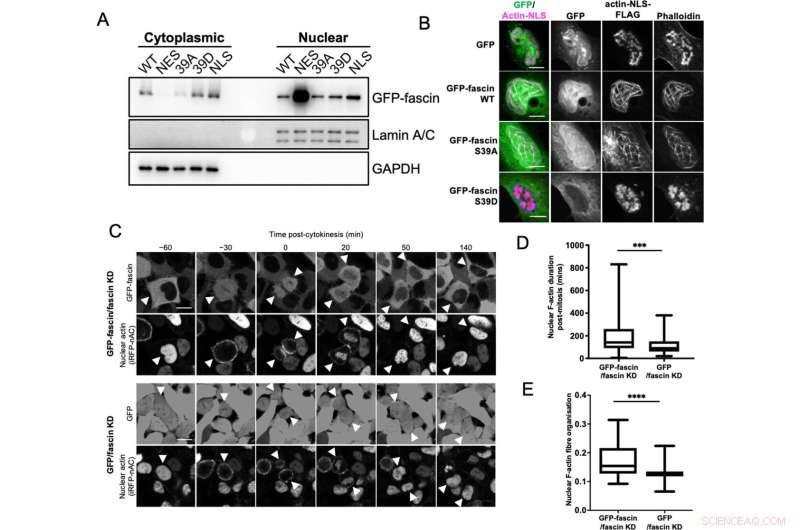
La fascinación nuclear contribuye a la formación de paquetes de actina F. (A) Western blot representativo de células HeLa de eliminación de fascin (KD) que expresan construcciones GFP-fascin específicas sujetas a fraccionamiento bioquímico. Compartimentos nucleares y citoplasmáticos sondeados para GFP-fascin (80 kDa), Lamin A/C (69/62 kda) y GAPDH (36 kDa). Representante de tres experimentos independientes. (B) Imágenes confocales representativas de núcleos de células fascin KD HeLa que coexpresan construcciones GFP-fascin específicas (verde) y construcción actina-NLS-FLAG, fijadas y teñidas para FLAG (magenta) y F-actina (faloidina). Las barras de escala son de 10 µm. (C) Imágenes fijas representativas de películas confocales de lapso de tiempo de células fascin KD HeLa que coexpresan GFP o GFP-fascin (paneles superiores) y sonda de actina F nuclear iRFP-nAC (paneles inferiores) antes y después de la citocinesis. Las puntas de flecha apuntan a células hijas o en división. Las barras de escala son de 10 µm. (D) Cuantificación de la duración de los filamentos de actina F nuclear en las células como en (C). (E) Organización de actina F nuclear en células sincronizadas, 10 horas después de la liberación. Para (D) y (E), N=89–100 células/condición, agrupadas de tres experimentos independientes. Los gráficos muestran el mínimo/máximo y la media del conjunto de datos. ***=p <0,001, ****=p <0,0001. Crédito:eLife (2022). DOI:10.7554/eLife.79283
Los investigadores han demostrado que una proteína llamada fascin actúa en el centro de control de las células cancerosas e influye en su capacidad para repararse, crecer y moverse, según un estudio publicado hoy en eLife .
El estudio revela una ruta importante a través de la cual Fascin promueve el desarrollo del cáncer y proporciona información sobre posibles vías que podrían bloquear su acción.
Se sabe que Fascin controla las estructuras que permiten que las células se muevan, específicamente el ensamblaje de haces de una proteína llamada actina, que crean las diminutas "piernas" que las células cancerosas usan para migrar a sitios distantes dentro del cuerpo. También se sabe que Fascin se encuentra en niveles mucho más altos en la mayoría de los tumores sólidos, donde ayuda a las células cancerosas a migrar e invadir otros tejidos. Esta invasión, o "metástasis", de células tumorales es la razón principal por la que muchos cánceres son tan difíciles de tratar
"Hemos demostrado previamente que fascin reside en el centro de control de la célula, el núcleo, en ciertos momentos del ciclo de crecimiento de la célula", explica el autor principal Campbell Lawson, investigador asociado en el Centro Randall de Biofísica Celular y Molecular, King's College London. , Reino Unido. "Sin embargo, no se sabía cómo se controla el movimiento o la función de fascin dentro del núcleo, y esto dificulta nuestra capacidad para desarrollar tratamientos que bloquean su papel en la promoción del crecimiento y la propagación del cáncer".
Para comprender mejor a Fascin, el equipo creó una serie de líneas de células cancerosas con y sin Fascin funcional, así como un conjunto de "nanocuerpos" de Fascin marcados con marcadores fluorescentes, para alterar su ubicación en las células y explorar sus interacciones con otras proteínas en el núcleo.
Descubrieron que fascin se transporta activamente dentro y fuera del núcleo y, una vez allí, apoya el ensamblaje de los haces de actina. De hecho, las células sin fascin no pudieron construir haces de actina nuclear en la misma medida. Fascin también interactuó con otro grupo de proteínas importantes en el núcleo celular, llamadas histonas. Cuando fascin no participa en la agrupación de actina, se une a la histona H3, un actor importante que participa en la organización del ADN dentro del núcleo.
Dada la interacción de fascin con las histonas, el equipo analizó si fascin también participaba en los procesos de reparación del ADN en las células cancerosas, lo que les ayuda a sobrevivir. Descubrieron que la reparación del ADN se vio afectada en las células que carecían de fascin, lo que indica que la proteína podría ser necesaria para que las células cancerosas desencadenen su respuesta al daño en el ADN causado por la quimioterapia o la radioterapia. Las células sin fascin también tuvieron cambios en su estructura de cromatina (la forma en que el ADN está empaquetado en la célula) en comparación con las células con niveles normales de fascin.
Aunque la fascina nuclear juega un papel importante en el ensamblaje de la actina nuclear, la estructura y la reparación del ADN, también es importante en el citoplasma celular, donde ayuda a las células cancerosas a construir pequeños apéndices llamados filopodios, que promueven la invasión. Entonces, el equipo quería entender si mover todo el fascin al núcleo evitaría la función citoplasmática del fascin.
Como anticiparon, en las células con fascina nuclear mejorada, el número de filopodios se redujo significativamente porque no había fascina en el citoplasma para apoyar el ensamblaje de estas estructuras. Las células también invadieron menos los andamios tridimensionales que imitan el tejido que rodea a los tumores. Es importante destacar que las células que habían forzado la fascina nuclear habían reducido significativamente las tasas de crecimiento y la viabilidad porque ensamblaron grandes haces de actina estables en el núcleo que les impidieron pasar por el ciclo celular. En conjunto, estos resultados indican que, en lugar de tratar de encontrar formas de bloquear la fascina, forzarla a entrar en el núcleo de las células cancerosas podría evitar su crecimiento y movimiento.
"Nuestro estudio proporciona información sobre un nuevo papel para fascin en el control de la agrupación de actina nuclear para apoyar la viabilidad de las células tumorales", concluye la autora principal Maddy Parsons, profesora de biología celular en el Centro Randall de biofísica celular y molecular del King's College de Londres. "Dado que la fascin se encuentra en niveles muy altos en muchos tumores sólidos, pero no en los tejidos normales, esta molécula es un objetivo terapéutico interesante. Proponemos promover la acumulación de fascin en el núcleo de las células cancerosas, en lugar de enfocarse únicamente en atacarla en la célula. citoplasma, podría ser un enfoque alternativo que prevendría tanto el crecimiento como la propagación del tumor". Cómo los núcleos celulares se comprimen en espacios reducidos