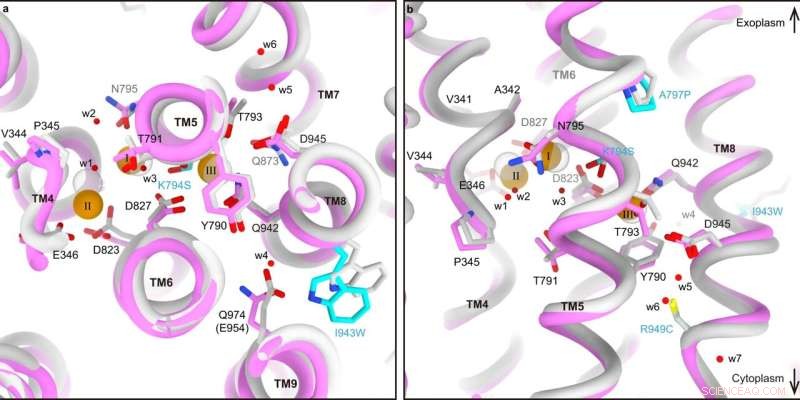
Comparación del sitio de unión de cationes entre SPWC-ngHKA y NKA. a, b Sitios de unión de cationes superpuestos de SPWC-ngHKA en 3Na + ·Estado E1-ATP (tubos y palos rosas) y el (3Na + )E1P-ADP estado de NKA (gris claro, 3wgu) visto desde el lado citoplásmico (a), o paralelo a la membrana con el lado extracelular hacia arriba (b). Los residuos mutados se indican con carbonos cian. Los tres Na + los iones (naranja) y siete moléculas de agua (w1–w7, rojo) identificadas en el mapa crio-EM de SPWC-ngHKA se muestran como esferas. Todos los modelos están alineados por su región inmóvil TM7-10. Crédito:Comunicaciones de la naturaleza (2022). DOI:10.1038/s41467-022-32793-0
En un artículo de investigación publicado recientemente, Pablo Artigas, Ph.D., del Centro de Investigación de Proteínas de Membrana del Departamento de Fisiología Celular y Biofísica Molecular de la Facultad de Medicina del Centro de Ciencias de la Salud de la Universidad Tecnológica de Texas (TTUHSC), y un equipo de colaboradores aplicaron análisis funcionales y estructurales para investigar qué características estructurales del protón/potasio (H + /K + ) bombas y sodio/potasio (Na + /K + ) las llevan a regular el paso de sales a través de barreras de membrana.
El estudio, "Estructura y Función de H + /K + Los mutantes de la bomba revelan Na + /K + Pump Mechanisms", fue publicado en septiembre por Nature Communications . El equipo de investigación incluyó a los estudiantes graduados de Artigas y TTUHSC Victoria C. Young, Ph.D., y Dylan J. Meyer, Ph.D.; Hanayo Nakanishi, Ph.D., Atsunori Oshima, Ph.D., y Kazuhiro Abe, Ph.D., de la Universidad de Nagoya (Japón); y Tomohiro Nishizawa, Ph.D., de la Universidad de la Ciudad de Yokohama (Japón).
En cada célula humana, el Na + /K + bomba transporta dos potasio (K + ) iones en la célula y saca tres sodio (Na + ) iones. Los gradientes de concentración de estos iones son necesarios para la señalización eléctrica en el cerebro, el corazón y los músculos, y para la ingesta de nutrientes y la regulación de las concentraciones intracelulares de calcio y protones en todos los tipos de células. Los cuatro tipos de Na + /K + las bombas se localizan en diferentes tejidos. Mutaciones de enfermedades dentro de tres de estos Na + /K + bombas causan trastornos neuromusculares, cognitivos, endocrinos o cardiovasculares.
Dos H + /K + Las bombas tienen sitios de reconocimiento de iones ligeramente diferentes y se expresan en el lado apical de muchos epitelios, donde transportan un protón (H + ) fuera de la célula y traer un potasio (K + ) ión. La H + gástrica /K + bomba acidifica el estómago y es el objetivo del omeprazol, un fármaco antiácido. El H + no gástrico /K + bomba participa en K + reabsorción y contribuye a la acidificación de las vías respiratorias, una parte importante de la patología de la fibrosis quística.
"Las dos proteínas (H + /K + y Na + /K + bombas) son aproximadamente un 70 % idénticas, por lo que observamos qué diferencias menores podrían ser responsables de la diferencia en la selectividad y en la cantidad de iones que se transportan", explicó Artigas.
El estudio determinó que reemplazar simultáneamente los residuos de aminoácidos en cuatro puntos dentro del H + no gástrico /K + bomba con los presentes en el Na + /K + la bomba es suficiente para transformar una proteína que normalmente transporta un protón por un potasio en una que transporta tres sodio por dos potasio, dando una nueva perspectiva sobre cómo estas proteínas seleccionan los iones que deben transportar.
"Hasta donde sabemos, esta es la primera demostración del cambio de una proteína que transporta exclusivamente H + se transforma en una proteína que transporta exclusivamente Na + ", dijo Artigas. "Creemos que podría ayudar a otros a realizar trabajos similares con otras proteínas de membrana para diseñar un cambio similar en la selectividad entre Na + y H + . Podemos hacerlo de una manera, pero ahora estamos tratando de hacerlo de otra manera:venga del Na + /K + bomba a la H + (no gástrica) /K + bomba".
La importancia del H + no gástrico /K + la bomba en el cuerpo sigue siendo en gran parte desconocida, pero se sabe que su inhibición previene las infecciones de las vías respiratorias en un modelo animal de fibrosis quística.
"Además de transformar un tipo de proteína en otro, gracias a nuestros colaboradores biólogos estructurales en Japón, determinamos la estructura del H + no gástrico /K + bomba", dijo Artigas. "Esta estructura podría usarse para desarrollar inhibidores específicos para tratar eficazmente a los pacientes con fibrosis quística".
Ahora que Artigas y sus colaboradores han convertido con éxito el H + no gástrico /K + bomba a un Na + /K + bomba, están intentando varias otras conversiones utilizando la bomba gástrica H + /K + y Na + /K + bombas.
"Aún no hemos podido convertir el H + gástrico /K + bomba en un Na + /K + bomba o un Na + /K + bomba en un H + /K + bomba para comprender completamente el mecanismo de selectividad", dijo Artigas. "Usaremos las estructuras actuales y futuras de la H + no gástrica /K + bomba para intentar generar inhibidores específicos para ayudar a tratar a los pacientes con fibrosis quística". + Explore más