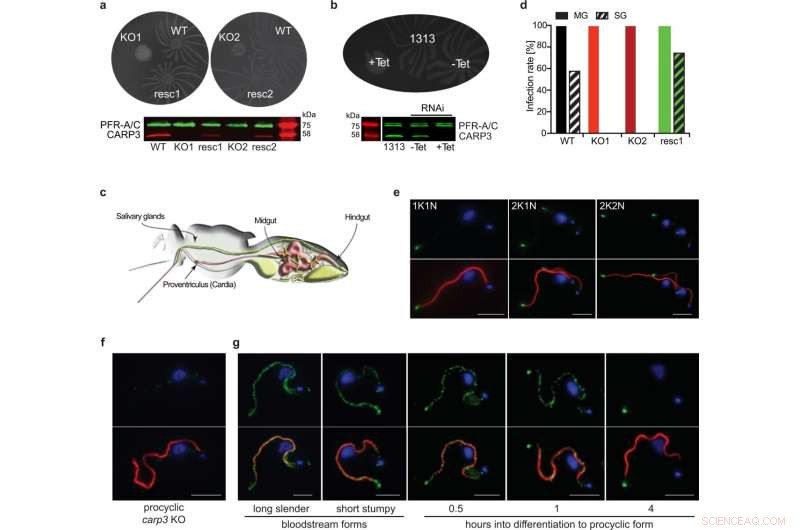
CARP3 es un regulador de la punta flagelar de la motilidad social (SoMo) y es esencial para la colonización de las glándulas salivales de la mosca tsetsé. a Ensayos SoMo de T. brucei procíclico AnTat 1.1 de tipo salvaje (WT), knock-out de carp3 (KO, clones independientes KO1, KO2) o rescate de CARP3 in situ (resc, clones independientes resc1, resc2). El Western blot se probó con anti-CARP3 y anti-PFR-A/C (control de carga). b Ensayo SoMo sobre ARNi inducible por tetraciclina (Tet) de CARP3 (-Tet / +Tet 24 h) y la línea celular parental AnTat 1.1 1313. El Western blot muestra la represión de CARP3 detectada por anticuerpos como en (a). c Ilustración del sistema digestivo y las glándulas salivales de una mosca tsetsé (adaptado de 91). d Tasas de infección del intestino medio de la mosca tsetsé (MG) o glándulas salivales (SG) con líneas celulares T. brucei AnTat 1.1 como en (a). Las moscas se diseccionaron 34-36 días p.i., n (moscas) =48 (WT), 50 (KO1), 50 (KO2), 40 (resc1). Se incluyó L-glutatión 10 mM en la harina de sangre (colonia de moscas tsetsé del Instituto de Medicina Tropical de Amberes). Análisis de inmunofluorescencia indirecta de CARP3 (verde) en T. brucei AnTat 1.1 forma procíclica WT (e) o carp3 KO (f). Los paneles superiores muestran CARP3 (verde) y el ADN nuclear y mitocondrial teñido con DAPI (azul), los paneles inferiores muestran una superposición con el axonema (rojo; teñido con el anticuerpo mAB25). En (e) se muestran células en diferentes etapas del ciclo celular (1K1N, 2K1N, 2K2N; cinetoplasto K, núcleo N). g Análisis de inmunofluorescencia indirecta de CARP3 (verde) como en (e, f) durante la diferenciación del cultivo del torrente sanguíneo a las formas procíclicas. Barra de escala en (e–g) 5 µm. Los datos de origen para (a, b) y (d) se proporcionan como archivo de datos de origen. Crédito:Comunicaciones de la naturaleza (2022). DOI:10.1038/s41467-022-33108-z
Los investigadores de LMU han descifrado un mecanismo de señalización crucial que permite que los tripanosomas lleguen a las glándulas salivales de las moscas.
Las moscas tsetsé son comunes en gran parte de África. Se alimentan de la sangre de humanos y otros animales. En el proceso pueden transmitir tripanosomas, un parásito protozoario. Trypanosoma brucei causa la enfermedad del sueño en humanos. Los patógenos se infiltran en el huésped a través de la saliva de las moscas tsetsé infectadas:desde la sangre, llegan al cerebro y provocan síntomas fatales si no se tratan.
Pero, ¿cómo llegan los tripanosomas a las glándulas salivales de las moscas tsetsé después de alimentarse de sangre? La Dra. Sabine Bachmaier y el profesor Michael Boshart de la división de Genética de la Facultad de Biología de LMU, junto con colegas científicos, han encontrado una respuesta sorprendente a esta pregunta.
Muestran que un aparato de señalización en la punta flagelar de los protozoos controla la migración de tripanosomas en la mosca tsetsé a través del mensajero conocido como monofosfato de adenosina cíclico (cAMP). La eliminación de un componente del complejo enzimático que produce la molécula de señalización de cAMP fue suficiente para prevenir la infección de las moscas. Los resultados del estudio ahora se han publicado en Nature Communications .
Información sobre la red reguladora
A título informativo:El ganado vacuno y los antílopes son reservorios naturales de Trypanosoma brucei. Durante una comida de sangre, los patógenos ingresan al tracto gastrointestinal de las moscas tsetsé. Para sobrevivir y propagarse aún más, los tripanosomas necesitan adaptarse a su entorno cambiante. Migran de un lado a otro entre el torrente sanguíneo y los tejidos de un huésped mamífero y entre el tracto digestivo y las glándulas salivales de una mosca tsetsé, por lo que pasan por una serie de etapas de desarrollo.
"Nuestro proyecto se basa en varias colaboraciones internacionales con grupos de investigación en París, Amberes y Río de Janeiro", dice Bachmaier. "Durante mucho tiempo nos había interesado la cuestión de cómo los parásitos logran orientarse en la mosca tsetsé y cómo se podría prevenir para controlar la transmisión de la enfermedad".
Hace unos diez años, el grupo de investigación identificó un componente nuevo y específico del tripanosoma de la vía de señalización del AMPc:la proteína de respuesta al AMP cíclico 3 (CARP3). "Nuestro descubrimiento de que CARP3 se encuentra principalmente en la punta de los flagelos de los tripanosomas nos puso sobre la pista de un aparato de señalización especializado para la orientación de los parásitos en la mosca tsetsé", dice Bachmaier.
Cuando los investigadores eliminaron el gen CARP3 mediante ingeniería genética, la composición de las enzimas (adenilato ciclasas) que producen cAMP en la punta flagelar también cambió. "Los tripanosomas ya no fueron capaces de colonizar eficientemente las moscas tsetsé", explica el científico. "En las glándulas salivales, ya no encontramos ni una sola célula de los parásitos".
De la investigación básica a la aplicación:el objetivo de una estrategia a largo plazo podría ser alterar las interacciones entre CARP3 y las adenilato ciclasas. Esto podría hacerse, por ejemplo, mediante un péptido sintético que se produciría en las moscas mediante la técnica conocida como paratransgénesis. Sin colonizar las glándulas salivales de las moscas tsetsé, los tripanosomas ya no se transmitirían. Cómo las moscas tsetsé transmiten Nagana