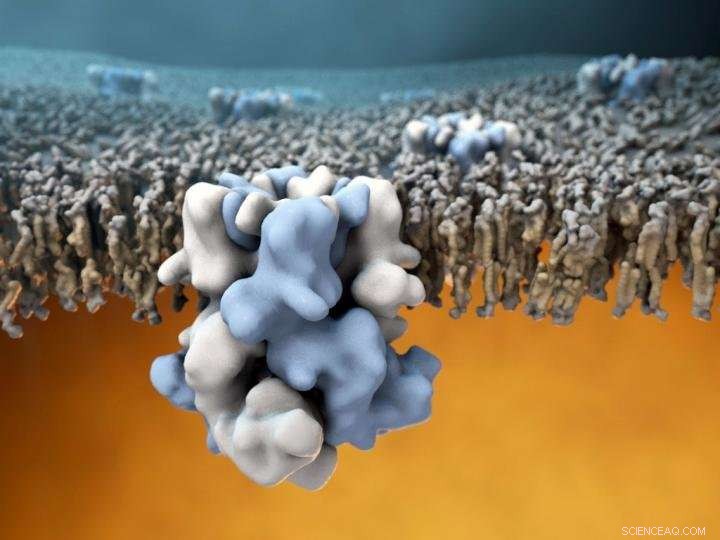
El canal de iones TRPM8 (azul y blanco en el centro) está incrustado en la membrana externa de las células, y es capaz de detectar temperaturas frías en el exterior (la mitad superior de la imagen), y comunicar esta información al cálido interior celular (mitad inferior de la imagen). Crédito:Gabe Lander y Graham Johnson
Un equipo de investigadores del Instituto de Investigación Scripps (TSRI) y la Universidad de Duke ha realizado la primera determinación de la estructura atómica del potencial receptor transitorio de la melastatina 8 (TRPM8), un sensor molecular en las terminaciones nerviosas que detecta temperaturas frías, así como mentol y otras sustancias químicas que inducen sensaciones de frío.
Este hallazgo debería impulsar los esfuerzos en curso de los científicos para apuntar a TRPM8 terapéuticamente. Los compuestos farmacológicos que interactúan con el sensor de frío, como ya lo hacen los ungüentos que contienen mentol, pueden ser capaces de tratar algunas formas de dolor e inflamación crónicos. migrañas e incluso cánceres.
"Conociendo la estructura atómica de TRPM8 y cómo reacciona al frío, el mentol y otros estímulos deberían ayudar en el diseño de nuevos fármacos potentes y selectivos dirigidos a este sensor, "dijo el líder del estudio Gabriel C. Lander, Doctor., profesor asociado en TSRI, quien codirigió el estudio con el Dr. Seok-Yong Lee en la Facultad de Medicina de la Universidad de Duke.
El descubrimiento, publicado el 7 de diciembre de 2017 en la revista Ciencias , también es una hazaña técnica significativa. Desde que se identificó por primera vez la proteína sensible al frío en 2002, equipos de todo el mundo han intentado, pero no han podido determinar la estructura atómica de TRPM8 utilizando cristalografía de rayos X, tradicionalmente, el método de referencia para resolver estructuras de proteínas grandes. La obtención de una estructura de alta resolución de TRPM8 ha planteado un gran desafío para los biólogos estructurales, en parte debido a la inestabilidad del canal cuando se aísla de su entorno nativo en la membrana celular. Sin soporte de membrana, TRPM8 tiene tendencia a perder su integridad estructural, haciendo que el objetivo sea muy difícil de estudiar. La estructura del sensor TRPM8 también es relativamente compleja, estando compuesto por cuatro copias idénticas de la proteína codificada por el gen TRPM8.
Para este proyecto, Lander y el co-primer autor Mengyu Wu, un estudiante de posgrado en su laboratorio, optó en su lugar por utilizar microscopía crioelectrónica (cryo-EM), un método de determinación de la estructura que se prefiere cada vez más para estudios estructurales difíciles. Lee y su equipo comenzaron examinando proteínas TRPM8 de más de una docena de especies animales diferentes, incluidos los humanos, ratones, y pájaros, para encontrar uno que probablemente "se comportara mejor" para un estudio de crio-EM. Se decidieron por la proteína TRPM8 de un pájaro llamado papamoscas de collar.
"Toda la evidencia apunta a que el papamoscas TRPM8 funciona de la misma manera que los TRPM8 de mamíferos, por lo que estamos seguros de que nuestro análisis estructural se traducirá directamente en la forma humana de este sensor, ", Dijo Lander.
Los científicos enfrentaron muchos obstáculos debido a la inestabilidad inherente de TRPM8 fuera de su entorno de membrana nativo. "Incluso dentro de un solo día de envío de las muestras de Duke a TSRI, el complejo de proteínas comenzaría a desmoronarse, ", dijo Wu." El laboratorio de Lee agregó estratégicamente algunas mutaciones estabilizadoras a la proteína para que fuera menos propensa a la degradación ". Ying Yin, un estudiante de posgrado en el laboratorio Lee, también regresó y se examinó meticulosamente a través de varias condiciones de purificación para conferir estabilidad adicional a la muestra.
La proteína también se comportó de manera diferente a la mayoría de las muestras en las que normalmente trabaja el laboratorio de Lander para microscopía electrónica. y los investigadores tardaron más de un año en identificar las condiciones adecuadas para obtener imágenes de esta desafiante biomolécula.
"Tuvimos que descartar el libro de reglas y repensar el enfoque habitual para resolver este tipo de estructura, —dijo Lander.
A través de estas adaptaciones, los investigadores pudieron obtener el primer vistazo estructural de TRPM8 con una resolución general de aproximadamente 4 Angstroms (0,4 mil millonésimas de metro). El modelo atómico resultante también contenía algunas sorpresas. "Otros grupos han formulado hipótesis sobre la estructura de TRPM8 y cómo interactúa con socios vinculantes como el mentol, pero lo que descubrimos fue que prácticamente todas estas conjeturas fundamentadas estaban bastante lejos, ", Dijo Lander. En particular, el bolsillo de encuadernación para mentol resultó estar en un lugar inesperado, diferente de la ubicación de unión del ligando en otros sensores TRP.
"Una cosa que nos dice esta estructura es que no todos los sensores TRP funcionan de la misma manera, por lo que espero que descubramos muchos nuevos mecanismos de sensores a medida que estudiemos más de estas estructuras de TRP, ", Dijo Lander.
TRPM8 es de interés para la industria farmacéutica en parte debido al analgésico, efectos antiinflamatorios que puede tener cuando se activa. Es más, variantes de su gen se han relacionado con una predisposición a las migrañas, y los científicos han demostrado que manipular TRPM8 puede causar un dolor similar a una migraña en los animales.
"TRPM8 también se expresa de forma anormal en algunas próstatas, cánceres de mama y otros, convirtiéndolo en un objetivo quimioterapéutico potencial, "Dijo Wu.
Aunque TRPM8 es mejor conocido como sensor de nervios periféricos de temperaturas moderadamente frías (por debajo de aproximadamente 25 ° C) y de moléculas de sensación de frío como el mentol, también se encuentra dentro de muchos otros tejidos normales, incluso en lo profundo del cuerpo, y sus funciones en esos tejidos siguen siendo poco claras. Una comprensión detallada de la interacción estructural de TRPM8 con sus socios de unión natural debería conducir al desarrollo de mejores sondas moleculares que puedan ayudar a los científicos a revelar sus diversas funciones.
Los Laboratorios Lander y Lee ahora están trabajando para comprender mejor cómo TRPM8 interactúa con el mentol y otras moléculas terapéuticas asociadas a la unión.