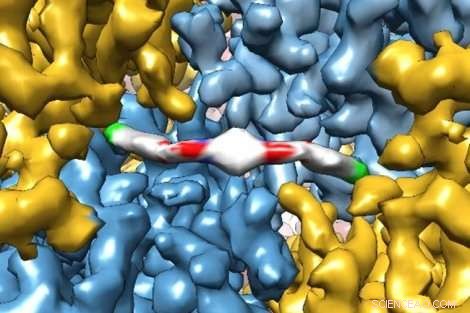
Una innovadora imagen de microscopía crioelectrónica muestra con extremo detalle cómo una nueva molécula terapéutica interactúa con una proteína, dando a los investigadores información sobre cómo funciona en el cuerpo humano. La molécula, ISRIB, se mostró en un estudio reciente de Peter Walter de UCSF, Doctor, y Susanna Rosi, Doctor, para restaurar la falla de la memoria en pacientes con traumatismo craneoencefálico. Crédito:Adam Frost Lab
Los investigadores de UC San Francisco capturaron recientemente imágenes exquisitas de una proteína atrapada en el acto de unirse a un fármaco terapéutico novedoso con suficiente resolución para modelar cómo se alinean los átomos individuales de la proteína y el fármaco.
Hasta hace poco, tal hazaña habría sido considerada imposible, pero en los últimos cinco años, tales avances se han convertido en casi un lugar común aquí, parte de una revolución de resolución liderada por investigadores de UCSF.
Gracias a sus recientes avances en microscopía crioelectrónica (crio-EM), una técnica cuyos inventores fueron galardonados con el Premio Nobel de Química 2017, estos investigadores han permitido un rápido avance en la búsqueda de terapias más precisas y potentes para una amplia gama de enfermedades humanas.
Las proteínas son diminutas máquinas moleculares que alimentan todo lo que hacen nuestras células, y también son los objetivos principales de los medicamentos farmacéuticos. Descubrir cómo funcionan las nuevas proteínas podría conducir a terapias para el cáncer que salvan vidas o nuevos analgésicos con menos peligro de adicción.
Pero para comprender verdaderamente cómo funcionan las proteínas, los investigadores deben poder visualizarlos a escala atómica. Anteriormente, esto requería cristales de una proteína en crecimiento minucioso, un proceso que podía tardar años en hacerse bien, y luego disparar rayos X a través de los cristales para calcular la composición atómica de la proteína. Desafortunadamente, muchas de las proteínas y complejos más interesantes no se pueden cristalizar.
Cryo-EM existe desde la década de 1970, pero desde 2013 los avances técnicos promovidos en parte por David Agard de UCSF, Doctor, y Yifan Cheng, Doctor, han mejorado drásticamente la capacidad de cryo-EM para resolver tanto las proteínas más pequeñas como las más complejas con un detalle asombroso, transformar el microscopio electrónico de un caballo de batalla anticuado del laboratorio a la más nueva super estrella científica casi de la noche a la mañana.
Este renacimiento de la crio-EM fue impulsado por los esfuerzos de Agard y Cheng para desarrollar hardware y software de cámara capaces de detectar electrones individuales, un objetivo que durante mucho tiempo había sido considerado poco práctico por el campo. pero que el dúo logró al reunir a científicos e ingenieros en UCSF, Laboratorio Nacional Lawrence Berkeley, y Gatan, un Pleasanton, Calif., empresa que fabrica cámaras EM.
"No hace mucho, todo el campo pensaba que contar electrones individuales nunca funcionaría, "Recuerda Cheng". Pero en UCSF, la cultura nos alimenta para hacer cosas que todos los demás piensan que son imposibles ".
A pesar del escepticismo de muchos de sus pares, Agard y Cheng, ambos profesores de bioquímica y biofísica en UCSF e investigadores del Instituto Médico Howard Hughes, reconocieron que la captura de electrones individuales era fundamental para la capacidad de los microscopios electrónicos de resolver proteínas biológicas clave con suficiente detalle para permitir a los científicos comprender su función.
Una ilustración muestra las imágenes crio-EM posibles antes de 2013 en el extremo izquierdo y las imágenes crio-EM de una resolución mucho más alta disponibles en la actualidad a la derecha. Estas imágenes de alta resolución hacen posible que los investigadores construyan modelos moleculares de proteínas difíciles de estudiar (extremo derecho). Crédito:Martin Högbom / La Real Academia Sueca de Ciencias
"No se trata solo de ver las proteínas con un poco más de claridad, "Agard explicó." Hay un punto preciso en el que se pasa de ver manchas bastante inútiles a ser capaz de interpretar directamente la estructura de una molécula. Las cámaras de conteo de electrones realmente proporcionaron un salto cuántico en nuestra capacidad para comprender la química subyacente de una proteína, tanto cómo funciona como cómo se pueden diseñar medicamentos que se unan a ella ".
Desde su primer artículo de gran éxito en 2013 que demuestra que las nuevas cámaras y software pueden resolver proteínas en una resolución casi atómica, la tecnología ha tenido una amplia adopción en el campo. También ha hecho posibles grandes avances en la propia investigación de Cheng y Agard, desde la comprensión de las proteínas clave hasta la sensación de dolor, que podría ser el objetivo de una nueva generación de productos farmacéuticos, a descubrimientos sobre cómo las proteínas mantienen su forma adecuada, que tiene importantes implicaciones para el cáncer y enfermedades como la enfermedad de Alzheimer que se caracterizan por proteínas deformadas.
Otro investigador líder en cryo-EM en UCSF, Adam Frost, MARYLAND, Doctor, quien se incorporó a la universidad como profesor asistente en 2014 para aprovechar el poder de esta nueva tecnología, ha estado liderando esfuerzos para utilizar crio-EM para determinar cómo las nuevas clases de fármacos se unen a sus proteínas diana a nivel atómico.
"Cryo-EM ahora nos permite estudiar proteínas con un nivel de detalle que nunca hubiera sido posible hace unos años, "Dijo Frost.
Frost y Cheng también han estado usando crio-EM para comprender cómo las proteínas de señalización en las superficies de las células, objetivos clave para los productos farmacéuticos, desde analgésicos hasta terapias contra el cáncer, están influenciadas por las membranas celulares en las que flotan y cómo las proteínas pueden doblarse y dar forma a las células. membranas. Notablemente, the ability to examine the structure of proteins in their native membranes – which had also been considered impossible by the field – was achieved for the first time in 2016 by Cheng.
The recent work with cryo-EM has been so successful that many researchers at UCSF have begun clamoring for a share of the limited microscopy time available on shared scopes. Afortunadamente, with the acquisition earlier this year of new fully automated cryo-electron microscopes, including a $5 million state-of-the-art Titan Krios system funded by the Howard Hughes Medical Institute, a $6 million Titan Krios funded by an anonymous donor for the UCSF Institute of Neurodegenerative Disease – part of the UCSF Weill Institute for Neurosciences – and a $3 million Arctica system funded by the National Institutes of Health and UCSF, more and more researchers across the University and the Bay Area will be able to take their research to the next level.
Agard sees the cryo-EM revolution as closely synergistic to other burgeoning efforts on campus to completely map out the biology of disease, such as the work of Nevan Krogan, Doctor, the director of UCSF's Quantitative Biosciences Institute, who is mapping the common networks of genes and proteins that drive diseases ranging from cancer to HIV to schizophrenia; and the work of Brian Shoichet, Doctor, whose lab in UCSF's School of Pharmacy uses protein structures to computationally design custom drugs that fit like lock and key into target proteins.
"There is a remarkably integrated pipeline being developed at UCSF, with new technologies and approaches feeding off one another to advance our knowledge of the biology of disease at every level, " Agard said. "This is beginning to have a huge impact all around campus, but now we need to scale it up to lower barriers and speed the transition from images to therapies."