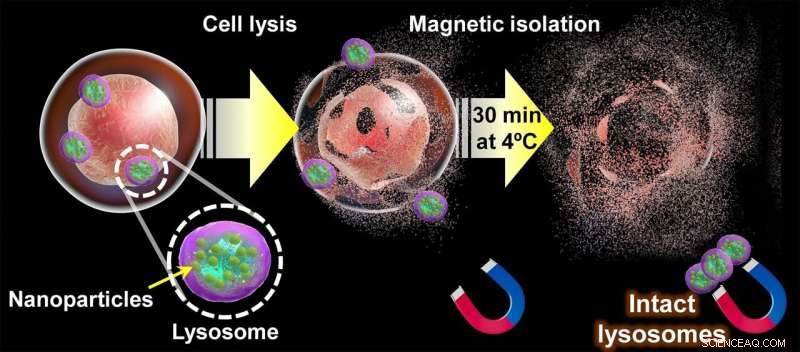
Diagrama del enfoque propuesto para extraer lisosomas intactos. Una vez que las nanopartículas magnéticas se han acumulado naturalmente en los lisosomas de una célula a través de la vía endocítica, la membrana celular se rompe. y su contenido “tamizado” durante 30 minutos mediante imanes. Al final de este proceso, los lisosomas intactos pueden recuperarse de los imanes y usarse para estudiar su estructura, metabolitos y composición de proteínas. Crédito:Shinya Maenosono
El correcto funcionamiento de las células se basa en la orquestación precisa de muchos procesos y orgánulos complejos. Los lisosomas, orgánulos de células vitales, son subunidades llenas de enzimas que se encuentran dentro de muchas células animales y que ayudan a descomponer y reutilizar macromoléculas, como proteínas, lípidos y nucleótidos. Además de su función en la digestión celular y el manejo de desechos, los lisosomas también participan en la señalización de aminoácidos, lo que estimula la síntesis de proteínas junto con otros efectos.
Dado que muchas enfermedades son causadas por defectos en la función de los lisosomas, no sorprende que los investigadores hayan estado tratando activamente de comprender estos orgánulos durante décadas. Pero solo hay unas pocas técnicas que permiten la extracción de lisosomas desde el interior de una célula. El método más común se llama "ultracentrifugación en gradiente de densidad". Implica romper suavemente la membrana celular y aplicar una fuerza centrífuga al contenido de la célula. Esto separa los componentes celulares por densidad. Desafortunadamente, algunos otros orgánulos tienen la misma densidad que los lisosomas, lo que genera muestras con impurezas. Además, el proceso lleva tanto tiempo que, cuando finaliza, muchas proteínas lisosomales ya se han perdido y/o degradado.
Una técnica más avanzada, llamada "inmunoprecipitación", se basa en la modificación de las proteínas de la superficie de los lisosomas para que puedan ser capturadas por perlas magnéticas cubiertas con anticuerpos especialmente diseñados. Si bien este enfoque produce resultados más puros, la composición de proteínas de los lisosomas extraídos se modifica por el procedimiento y, por lo tanto, los análisis de proteínas posteriores pueden verse comprometidos. Está claro, entonces, que necesitamos encontrar una mejor manera de extraer los lisosomas de las células.
Afortunadamente, un equipo de científicos dirigido por el Prof. Shinya Maenosono del Instituto Avanzado de Ciencia y Tecnología de Japón (JAIST) ha dado un paso al frente y ha desarrollado una estrategia novedosa para separar rápidamente los lisosomas intactos con alta pureza. Este estudio fue publicado en ACS Nano y también incluyó al Prof. Kazuaki Matsumura y al Prof. Asociado Yuichi Hiratsuka de JAIST, y al Prof. Tomohiko Taguchi de la Universidad de Tohoku, Japón.
Su estrategia se centra en el uso de nanopartículas híbridas magnético-plasmónicas (MPNP) hechas de plata y una aleación de hierro y cobalto y recubiertas de un compuesto llamado amino dextrano (aDxt). La base de este enfoque es que las MPNP cubiertas por aDxt son ingeridas naturalmente por las células a través de la "endocitosis", que culmina dentro de los lisosomas. Una vez que se han acumulado suficientes MPNP dentro de los lisosomas, las células se pueden "aplastar" suavemente y los lisosomas se pueden recuperar con imanes.
Para que este método funcione, es esencial que los MPNP se encuentren solo dentro de los lisosomas y no en otros orgánulos. Aquí es donde las imágenes de plasmones son útiles, ya que la forma distinta en que las nanopartículas plasmónicas interactúan con la luz las hace fáciles de visualizar con un microscopio óptico. Al colorear cada tipo de orgánulo en la vía endocítica de manera diferente usando inmunotinción y verificando cómo la ubicación de los MPNP se superpone con ellos, los investigadores determinaron el tiempo preciso que tarda la mayoría de los MPNP en llegar a los lisosomas. A su vez, esto garantiza que el proceso de separación produzca muestras de lisosomas de alta pureza.
Posteriormente, el equipo analizó los efectos de la temperatura y el tiempo de separación magnética en la composición proteica de los lisosomas extraídos. Sus resultados mostraron que la pérdida de proteínas fue notablemente rápida, incluso a temperaturas tan bajas como 4°C. Afortunadamente, su enfoque fue lo suficientemente rápido para extraer lisosomas intactos, como destaca el profesor Maenosono:"Descubrimos que el tiempo máximo requerido para aislar los lisosomas después de la ruptura celular fue de 30 minutos, que es sustancialmente más corto que el tiempo requerido usando técnicas basadas en centrifugación, que normalmente requieren un tiempo mínimo de separación de varias horas".
En general, esta nueva técnica ayudará a los investigadores a explorar los frágiles metabolitos de los lisosomas y cómo cambian en respuesta a los estímulos. A su vez, esto allanará el camino para nuevos conocimientos sobre los trastornos relacionados con la disfunción lisosomal. Al respecto, el Prof. Maenosono comenta:“Dada la profunda relación de los lisosomas con muchos metabolitos celulares, es necesario un conocimiento más profundo de la función lisosomal para determinar su regulación en diferentes estados celulares. Por lo tanto, nuestra técnica puede contribuir a una mejor comprensión y tratamiento de enfermedades lisosomales en el futuro". Además, este nuevo enfoque podría modificarse para extraer otros orgánulos además de los lisosomas. Con suerte, este estudio nos acercará a la comprensión del contenido de las células en un grado mucho mayor. Los investigadores realizan perfiles metabolómicos de lisosomas agrandados individuales