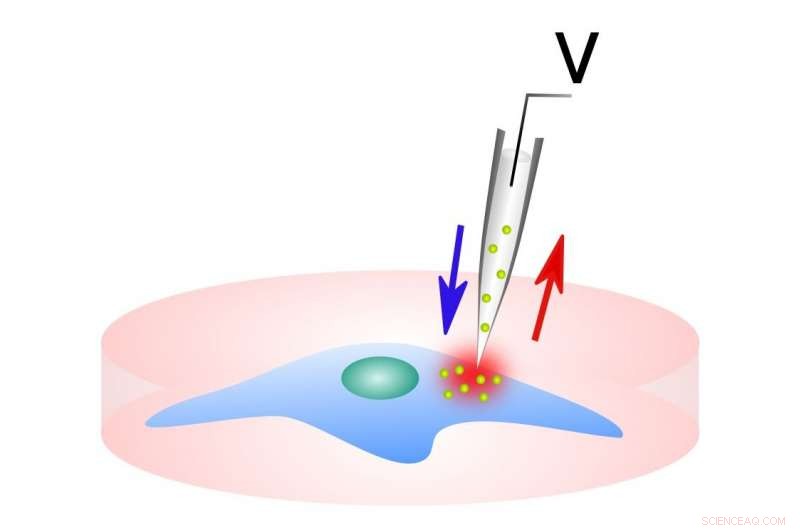
Esta imagen muestra el sistema de entrega / muestreo. Crédito:Escuela de Ingeniería Northwestern McCormick
Las líneas celulares inyectadas con ácido nucleico libre se utilizan ampliamente para el descubrimiento de fármacos y el modelado de enfermedades. Para evitar poblaciones de células mezcladas genéticamente, los investigadores utilizan técnicas de dilución para seleccionar células individuales que luego generarán líneas idénticas. Sin embargo, la ruta de las diluciones limitantes es tediosa y requiere mucho tiempo.
Un nuevo estudio realizado por investigadores de Northwestern muestra cómo la electroporación de sonda nanofuente (NFP-E), una herramienta que entrega moléculas en células individuales, podría resolver ese problema, y podría dar lugar a nuevas aplicaciones para la detección de drogas y el diseño de tratamientos específicos para cada paciente.
El equipo, dirigido por Horacio Espinosa de Northwestern Engineering e incluyendo a Joshua Leonard, demuestra la versatilidad de NFP-E, que introduce ADN o ARN en las células utilizando electricidad. También puede administrar tanto proteínas como plásmidos en una variedad de tipos de células animales y humanas con control de dosis. El equipo incluía a John Kessler, el profesor Ken y Ruth Davee de biología de células madre y profesor de neurología y farmacología en la Facultad de medicina Feinberg de la Universidad Northwestern.
El nuevo método se puede utilizar para estudiar enfermedades o para terapia celular. En la antigua, se manipula el genoma. En lo ultimo, la edición de genes se produce en células como las células T para tratar el cáncer con inmunoterapias.
Empleando electroporación de celda única, el proceso de introducir ADN o ARN en células individuales usando un pulso de electricidad, que abren brevemente los poros de la membrana celular, su trabajo muestra cómo NFP-E logra un control fino sobre la expresión relativa de dos plásmidos cotransfectados. Es más, al emparejar la electroporación de celda única con imágenes fluorescentes de lapso de tiempo, su investigación revela tiempos característicos para el cierre de los poros eléctricos.
El muestreo antes de la electroporación. Crédito:Escuela de Ingeniería Northwestern McCormick
"Demostramos el potencial de la tecnología NFP-E en la manipulación de una variedad de tipos de células con control estequiométrico de carga molecular que se puede utilizar para realizar una amplia gama de estudios de detección de drogas, terapias celulares, y biología sintética, "dijo Espinosa, James N. y Nancy J. Farley Profesores en Fabricación y Emprendimiento y profesor de ingeniería mecánica y (por cortesía) ingeniería biomédica e ingeniería civil y ambiental.
En la actualidad, las biomoléculas se pueden administrar a las células de diversas formas:vectores virales; portadores químicos, tales como péptidos que penetran en las células y nanocápsulas poliméricas; lipofectamina, y electroporación a granel.
"Existe una serie de estrategias para introducir biomoléculas en las células, pero cada uno tiene sus limitaciones, "dijo Leonard, profesor asociado de ingeniería química y biológica y profesor Charles Deering McCormick de excelencia docente. "Por ejemplo, los vehículos químicos confieren un suministro relativamente lento y pueden ser tóxicos para la célula; los vectores virales suelen ser eficaces, pero pueden inducir respuestas inmunitarias adversas y genotoxicidad de inserción. El uso de cualquier método tradicional a menudo requiere un esfuerzo sustancial para optimizar el protocolo según el tipo de célula y la molécula que se administrará. y, por lo tanto, una estrategia de administración de biomoléculas fácilmente generalizable ofrecería algunas ventajas significativas ".
El nuevo sistema NFP-E permite la entrega de ADN a una sola célula, ARN, y proteínas en diferentes líneas celulares inmortalizadas, así como células primarias con más del 95 por ciento de eficiencia y más del 90 por ciento de viabilidad celular.
"Los resultados indican que el tiempo de resellado de la membrana celular se escala de forma no lineal con el voltaje del pulso y el número de pulsos de electroporación, alcanzando un máximo en valores intermedios, "Dijo Espinosa." Eso significa que los tiempos de pulsación prolongados o los voltajes altos parecen no ser necesarios para el transporte molecular eficiente a través de las membranas celulares. Esa característica es importante para obtener una alta eficiencia de transporte mientras se mantiene la toxicidad celular al mínimo ".
El muestreo después de la electroporación. Crédito:Escuela de Ingeniería Northwestern McCormick
Usando tecnología de electroporación de celda única, los investigadores pudieron comprender los mecanismos de transporte implicados en el muestreo celular localizado basado en electroporación. Un obstáculo para el muestreo temporal no destructivo de una sola célula son las pequeñas cantidades de citosol (el líquido dentro de las células) que se extraen, lo que dificulta probar o detectar secuencias de ARN o proteínas.
La investigación mostró que la escala del tiempo de resellado de la membrana es una función de varios parámetros de electroporación, proporcionando información sobre la dinámica de los electroporos posteriores al pulso.
"El trabajo aborda la necesidad de comprender formas de aumentar la cantidad de muestra de citosol, sin afectar negativamente a las células, "Eso puede guiar a la comunidad investigadora en el diseño de experimentos dirigidos al muestreo basado en electroporación de moléculas intracelulares para el análisis de células temporales", dijo Espinosa.
Esta investigación está relacionada con trabajos previos que desarrollaron un método mínimamente invasivo para muestrear células que se puede repetir varias veces. Esa investigación anterior, que usaba pulsos eléctricos para extraer enzimas del citosol, comprensión asistida de la cinética de formación y cierre de poros.
El papel, "La electroporación con sonda de nanofuente permite la entrega intracelular de una sola célula versátil y la investigación de la dinámica de los electrópores pospulso" se publicó el 2 de octubre en la revista. Pequeña .