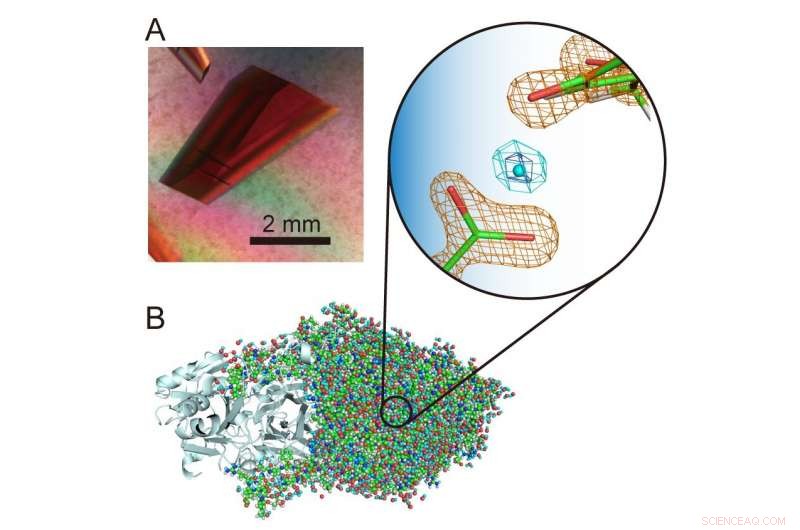
(A) Cristal extragrande de una amina oxidasa de cobre. (B) Estructura tridimensional de la amina oxidasa de cobre que incluye átomos de hidrógeno. Un protón "levitado" inusual se presenta en el centro de la vista ampliada. Crédito:Universidad de Osaka
Comprender el comportamiento de las proteínas y las enzimas es clave para descubrir los secretos de los procesos biológicos. Las estructuras atómicas de las proteínas se investigan generalmente mediante cristalografía de rayos X; sin embargo, la información precisa para los átomos y protones de hidrógeno (iones de hidrógeno) suele ser inalcanzable. Ahora un equipo que incluye a la Universidad de Osaka, Facultad de Medicina de Osaka, Institutos Nacionales de Ciencia y Tecnología Cuántica y Radiológica, Universidad de Ibaraki, y la Universidad de Tsukuba ha utilizado la cristalografía de neutrones para revelar detalles estructurales de alta resolución de una proteína oxidasa muy grande. Sus hallazgos se publican en PNAS .
Los átomos y protones de hidrógeno que constituyen aproximadamente la mitad de los átomos en proteínas y enzimas a menudo desempeñan papeles cruciales en el trabajo que realizan estas biomoléculas; sin embargo, sus posiciones exactas son difíciles de precisar debido a su pequeño tamaño. El enfoque más común para determinar la estructura de una proteína es dirigir un haz de rayos X de alta energía hacia un cristal de proteína y analizar el patrón de difracción que resulta de las interacciones de los rayos X con los electrones de los átomos en el estructura. Desafortunadamente, Los rayos X no interactúan fuertemente con los átomos o protones de hidrógeno, que tienen una densidad de electrones baja o nula, haciéndolos difíciles de "ver".
Una solución es aplicar un haz de neutrones al cristal en lugar de rayos X. Los neutrones interactúan con los núcleos de los átomos en su camino, incluidos los de átomos y protones de hidrógeno, a pesar de que son pequeños. Los patrones de difracción resultantes de estas interacciones se registran después de que el haz de neutrones haya atravesado el cristal. y se decodifican en las ubicaciones precisas de los núcleos, incluidos los núcleos de hidrógeno.
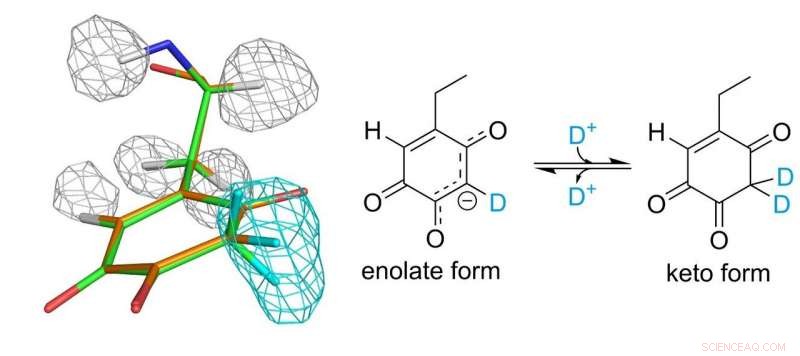
Estructura del cofactor de topa quinona. Las mallas gris y azul claro representan densidades de átomos de hidrógeno y deuterio, respectivamente. Crédito:Universidad de Osaka
"Los átomos y protones de hidrógeno son componentes particularmente interesantes de las estructuras enzimáticas porque pueden exhibir comportamientos cuánticos que recientemente se ha descubierto que son cruciales para la función enzimática. Por lo tanto, es importante determinar con precisión sus ubicaciones en la estructura de la proteína para desentrañar lo que está sucediendo. , "explica el autor correspondiente del estudio, Toshihide Okajima." Usando cristalografía de neutrones, pudimos determinar la estructura de una amina oxidasa de cobre bacteriana con un peso molecular de 70, 600, que es extremadamente grande para la cristalografía de neutrones y excede significativamente las masas moleculares registradas previamente, y aún ubica con precisión los átomos y protones de hidrógeno en la estructura. Se observó un protón inusual 'levitado' entre un cofactor, topa quinona, y un residuo de aminoácido estrictamente conservado en esta clase de enzimas ".
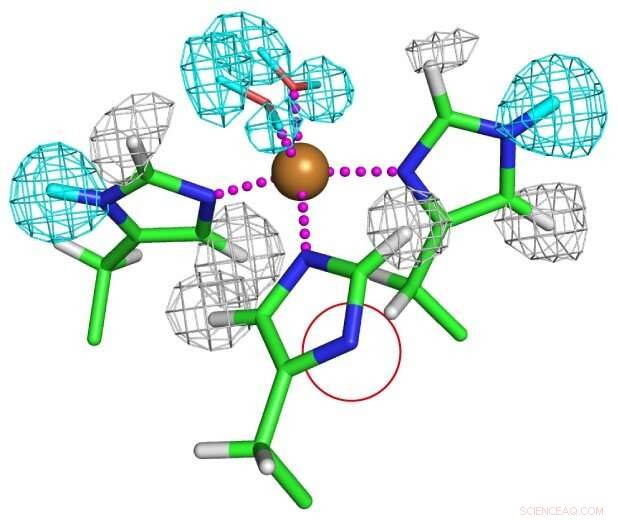
Estado de protonación de residuos de histidina coordinados con cobre. Uno de los residuos de histidina está completamente desprotonado como se muestra en un círculo rojo para formar un anión imidazolato inusual. Crédito:Universidad de Osaka
El cofactor de topa quinona unido covalentemente a la enzima juega un papel esencial en la función catalítica. Los investigadores finalmente pudieron establecer una imagen completa de la topa quinona 30 años después de su descubrimiento como cofactor derivado de proteínas. Descubrieron que el cofactor existe realmente en equilibrio entre dos formas diferentes.
"Los sitios activos de enzimas, donde tienen lugar las reacciones, pueden proporcionarnos una gran cantidad de información e inspiración si somos capaces de comprender completamente lo que está sucediendo, "Explica Okajima." Nuestra demostración del uso de la cristalografía de neutrones para descubrir los efectos cuánticos de los protones promete ser muy útil para muchos investigadores que estudian las enzimas y sus mecanismos ".