La nueva tecnología de secuenciación de proteínas con sensibilidad y rendimiento mejorados revolucionará la proteómica y el diagnóstico clínico.
En un estudio publicado en Nature Methods , un equipo de investigación dirigido por el Prof. Wu Haichen del Instituto de Química de la Academia China de Ciencias (CAS) y el Prof. Liu Lei del Instituto de Física de Altas Energías de la CAS, junto con sus colaboradores, han desarrollado un nuevo método para la secuenciación de péptidos basada en la detección de nanoporos asistida por la interacción huésped-huésped.
La historia de la secuenciación de proteínas se remonta a la determinación de la secuencia completa de aminoácidos de la insulina por Sanger en la década de 1950. Sin embargo, hasta ahora, sólo existen dos métodos principales para la secuenciación de proteínas:la espectrometría de masas y la degradación de Edman.
Durante las últimas décadas, la detección de nanoporos surgió como la última técnica "disruptiva" de una sola molécula y ha obtenido un gran éxito en la nueva generación de desarrollo de secuenciación de ADN. Esto ha inspirado a los científicos a trasplantar la tecnología a la secuenciación de proteínas de una sola molécula. Sin embargo, la secuenciación de proteínas por nanoporos enfrenta enormes desafíos, como la realización de un transporte unidireccional de cadenas peptídicas cargadas heterogéneamente a través de un nanoporo y la identificación eléctrica de 20 aminoácidos individuales o sus combinaciones.
En este estudio, los investigadores propusieron una estrategia de secuenciación alternativa basada en una técnica mejorada de detección de nanoporos asistida por la interacción huésped-huésped.
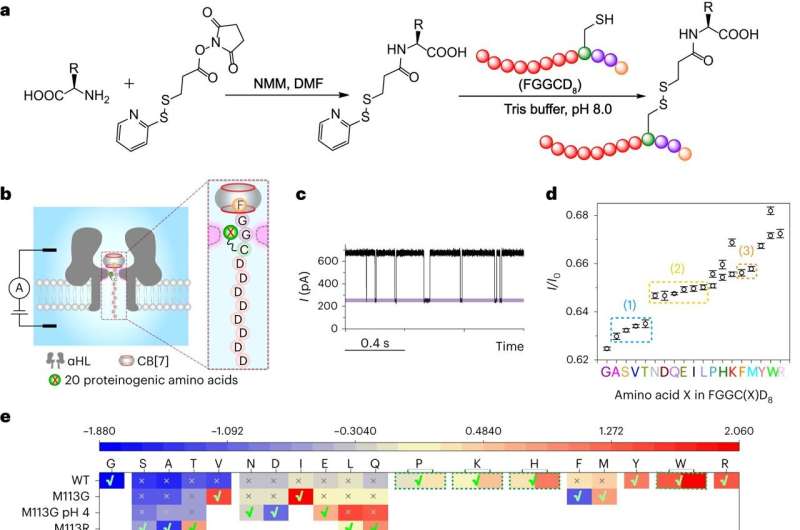
Los péptidos modelo se digirieron primero con carboxipeptidasas para producir una mezcla de aminoácidos. El siguiente paso clave fue acoplar los aminoácidos liberados a una sonda peptídica FGGCD8⊂CB[7] mediante un conector covalente y luego someter el complejo a experimentos de translocación a través de α-hemolisina de tipo salvaje o sus mutantes.
Finalmente, el bloqueo actual de cada péptido FGGC(X)D8⊂CB[7] se usó para identificar el aminoácido X y su abundancia relativa se usó para determinar el orden de la escisión enzimática, es decir, la secuencia del péptido. /P>
Este estudio sirve como demostración de prueba de concepto para un método novedoso capaz de determinar con precisión la secuencia de aminoácidos de un péptido. Si bien persisten limitaciones notables, esto marca un avance significativo y revela una vía prometedora para el futuro de la secuenciación de proteínas.
Más información: Yun Zhang et al, Secuenciación de péptidos basada en la detección de nanoporos asistida por interacción huésped-huésped, Nature Methods (2023). DOI:10.1038/s41592-023-02095-4
Información de la revista: Métodos de la naturaleza
Proporcionado por la Academia China de Ciencias