Los científicos del St. Jude Children's Research Hospital están abordando la resistencia a los antibióticos de Mycobacterium abscessus (Mab). Este patógeno naturalmente resistente a los antibióticos es cada vez más frecuente, lo que pone de relieve la necesidad urgente de nuevas terapias. Para abordar esto, los científicos diseñaron nuevas versiones del fármaco espectinomicina que superan el eflujo, el principal mecanismo que impulsa la resistencia. El trabajo está publicado en Proceedings of the National Academy of Science .
Las infecciones por Mab se encuentran cada vez más en entornos de atención médica. Estas infecciones pueden ser peligrosas para pacientes con función pulmonar comprometida, como en el caso de la fibrosis quística, o que están inmunológicamente comprometidos, como en el caso del cáncer infantil. Estas infecciones se tratan con ciclos prolongados de antibióticos y pueden tener malos resultados.
La aparición de Mab y otros patógenos similares presenta una amenaza creciente y profundamente preocupante para la salud pública porque hay pocas opciones terapéuticas efectivas y una línea limitada de desarrollo de fármacos.
"Nosotros, los químicos, estamos en una carrera contra los patógenos. Fabricamos antibióticos más fuertes y los patógenos se vuelven más resistentes", dijo el autor correspondiente Richard Lee, Ph.D., Departamento de Biología Química y Terapéutica de St. Jude.
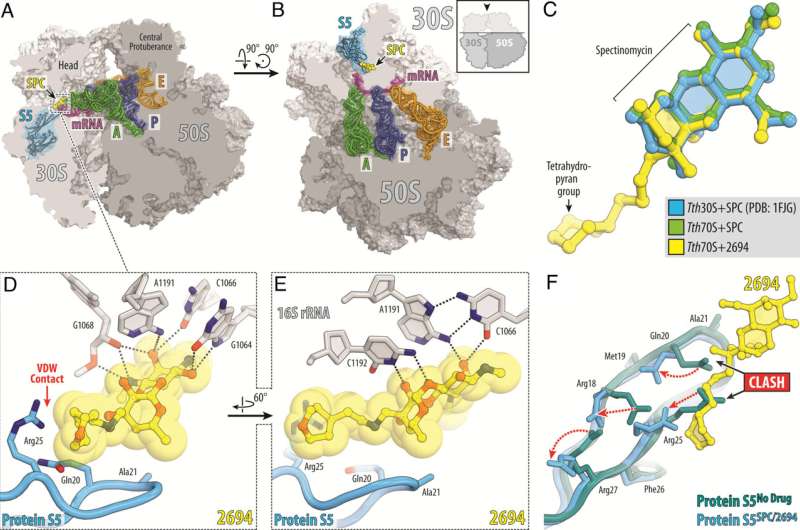
Los científicos de St. Jude modificaron el antibiótico natural espectinomicina para crear análogos, aminometil espectinomicinas comparables pero estructuralmente distintas unidas a N-etileno (eAmSPC). Estos eAmSPC creados sintéticamente son hasta 64 veces más potentes contra Mab que la espectinomicina estándar.
"Al rediseñar la molécula mediante el diseño de fármacos basado en la estructura, nosotros y nuestros colaboradores hemos adaptado el antibiótico para aumentar su actividad", añadió Lee.
A través de su trabajo, los científicos desentrañaron el mecanismo de acción por el cual los eAmSPC son más efectivos:evitan el flujo de salida. El flujo de salida es el proceso que utilizan las células para deshacerse de un fármaco (imagínese bombear agua desde un sótano inundado) y es un mecanismo importante mediante el cual las células se vuelven resistentes a la terapia.
La estructura de enlace N-etileno de las eAmSPC desempeña un papel fundamental en la forma en que los compuestos evitan el flujo de salida, lo que sugiere que los enlaces más largos modifican la forma en que el compuesto se bombea fuera de la célula. En última instancia, esto cambia el equilibrio hacia concentraciones más altas de eAmSPC dentro de la célula y, por lo tanto, mejora la eficacia antimicrobiana.
"Durante las últimas dos décadas, hemos visto un aumento masivo en el número de infecciones causadas por micobacterias no tuberculosas como Mab", dijo el coprimer autor Gregory Phelps, PharmD, St. Jude Graduate School of Biomedical Sciences. "Teníamos un punto de partida con este antibiótico natural que, mediante modificaciones, hemos hecho mucho más eficaz contra este patógeno clínicamente relevante".
Los investigadores también descubrieron que las eAmSPC funcionan bien con varias clases de antibióticos utilizados para tratar Mab y conservan su actividad contra otras cepas de micobacterias. Este trabajo demuestra que las eAmSPC deben estudiarse y desarrollarse más a fondo porque una vez que se aborden los problemas de tolerabilidad y seguridad, estos compuestos podrían convertirse en terapias de próxima generación.
"Es un desafío atraer a las compañías farmacéuticas para que desarrollen nuevos antibióticos por varias razones económicas", dijo Phelps. "Si podemos impulsar la producción de medicamentos contra esta bacteria difícil de tratar, potencialmente podemos marcar una diferencia para pacientes como los que tenemos aquí en St. Jude, que enfrentan cada vez más opciones terapéuticas limitadas o nulas".
Más información: Gregory A. Phelps et al, Desarrollo de aminometil espectinomicinas de segunda generación que superan el eflujo nativo en Mycobacterium abscessus, Actas de la Academia Nacional de Ciencias (2024). DOI:10.1073/pnas.2314101120
Información de la revista: Actas de la Academia Nacional de Ciencias
Proporcionado por St. Jude Children's Research Hospital