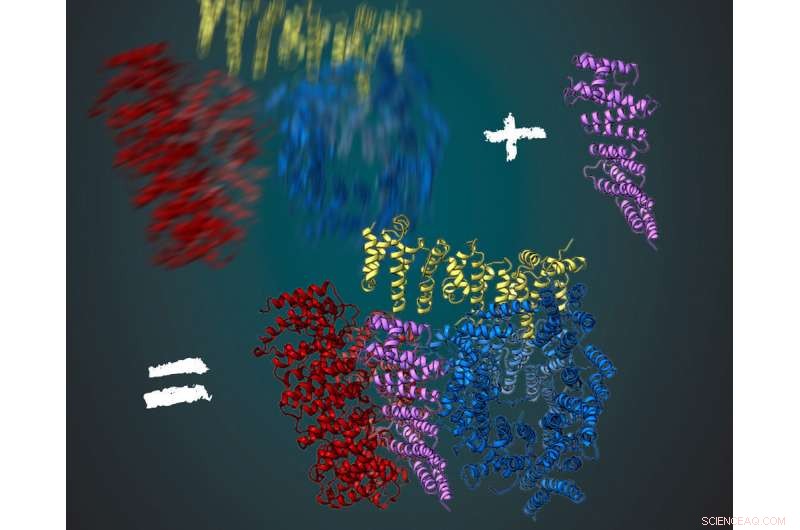
La proteína huntingtina consta de tres regiones flexibles, mostrado en rojo, amarillo y azul. Junto con su socio de interacción HAP40 (púrpura), la huntingtina es más estable. Esto permitió a los científicos deducir su estructura tridimensional utilizando microscopía crioelectrónica. Crédito:MPI de Bioquímica / Ilustración:Gabriele Stautner, ARTIFOX
Mutaciones en un solo gen, el gen de la huntingtina, son la causa de la enfermedad de Huntington. Conducen a una forma incorrecta de la proteína correspondiente. Con la ayuda de investigadores de microscopía crioelectrónica del Instituto Max Planck de Bioquímica en Martinsried y la Universidad de Ulm, ahora han decodificado el formato tridimensional, estructura molecular de la proteína huntingtina humana sana. Esto ahora permite su análisis funcional. Una mejor comprensión de la estructura y función de la proteína huntingtina podría contribuir al desarrollo de nuevos métodos de tratamiento en el futuro.
La enfermedad de Huntington a menudo comienza con trastornos emocionales y se caracteriza por movimientos musculares involuntarios y pérdida de la capacidad mental. Hasta hoy, la enfermedad neurológica es una de las enfermedades hereditarias aún incurables y fatales. La proteína HTT, también llamado huntingtina, juega un papel central en la enfermedad de Huntington. Desde hace 25 años se sabe que las mutaciones del gen de la huntingtina, que es el modelo para la misma proteína, causar la enfermedad de Huntington.
Aunque los investigadores han trabajado en él durante muchos años, todavía quedan muchos obstáculos por superar. Ahora Rubén Fernández-Busnadiego del Instituto Max Planck de Bioquímica y Stefan Kochanek, jefe del Departamento de Terapia Génica del Hospital Universitario de Ulm, han logrado decodificar el molecular, estructura tridimensional de la proteína huntingtina.
Stefan Kochanek y su equipo llevan mucho tiempo trabajando en la producción y purificación de huntingtina. ¿Qué ha impedido un análisis detallado de la proteína en las últimas décadas? Fernández-Busnadiego, un experto en microscopía crioelectrónica, menciona dos factores principales:"En primer lugar, La microscopía crioelectrónica solo se ha optimizado en los últimos años para observar estructuras de proteínas con una resolución casi molecular. La segunda razón es que la proteína huntingtina es muy flexible en su estructura. En este momento, también hemos encontrado una solución para este problema ". Durante el análisis, Se están tomando fotografías de la proteína desde diferentes perspectivas bajo el microscopio. La estructura molecular tridimensional se puede calcular a partir del gran número de imágenes resultantes. Para esto, la proteína debe estar siempre en la misma conformación. Fernández-Busnadiego explica:"Esto sería parecido a fotografiar a una persona en la oscuridad. Si la persona no se queda quieta un rato, la toma será borrosa ".
Para tener una imagen clara, Los investigadores del laboratorio de Kochanek han estado buscando otras proteínas que interactúen con la huntingtina y la estabilicen. Eso funcionó para la proteína HAP40. "La huntingtina en conexión con HAP40 se estabiliza en una conformación particular. Por lo tanto, promediado sobre muchas imágenes, pudimos derivar la estructura tridimensional, "dijo Kochanek." Si permanecemos en la analogía de la foto en la oscuridad, entonces la proteína actúa como una silla para la persona fotografiada. Sentado en él la persona se mueve mucho menos y la imagen es mucho más nítida con el mismo tiempo de exposición, ", añade Fernández-Busnadiego.
"Aunque sabemos desde hace algún tiempo que la mutación del gen de la huntingtina tiene graves consecuencias, todavía sabemos relativamente poco sobre la función y las tareas de la proteína saludable, "explica Kochanek. Las proteínas son las máquinas moleculares de la célula. Para cumplir con sus versátiles tareas, tienen una cierta estructura tridimensional, similar a un componente específico en una máquina. "Ahora que conocemos la estructura exacta de la huntingtina, Podemos estudiar más a fondo qué áreas de la huntingtina son particularmente importantes y cómo otras proteínas cooperan funcionalmente con la huntingtina. De esta forma, se podría deducir que ciertas estructuras son el objetivo terapéutico de ciertos fármacos ".
Ahora, Están sucediendo muchas cosas en la investigación de la enfermedad de Huntington. Gran esperanza se dirige a un método, que silencia el gen de la huntingtina con los llamados oligonucleótidos antisentido para el tratamiento de la enfermedad de Huntington. Estas pequeñas moléculas reducen la formación de proteínas huntingtina en las células, pero el fármaco no puede diferenciar entre la proteína huntingtina normal y la patológicamente alterada. También por esta razón, Es importante aprender más sobre la función de la proteína huntingtina saludable. Kochanek mira con confianza hacia el futuro:"La estructura decodificada nos dará un gran paso adelante".
"Actualmente, los ensayos de tratamiento con oligonucleótidos antisentido solo se llevan a cabo en muy pocas clínicas. La Clínica Universitaria Neurológica de Ulm lidera las pruebas de fármacos en Alemania. Algunos de los oligonucleótidos antisentido actualmente revisados reducen tanto la formación de la proteína huntingtina normal como la mutante, mientras que otros buscan predominantemente reducir la huntingtina alterada. Actualmente no está claro si una inhibición parcial de la formación de la proteína huntingtina normal tiene desventajas y se tolera sin efectos secundarios indeseables. Esta es otra razón más por la que es importante aprender más sobre la función normal de la proteína huntingtina. Para tal fin, el estudio hará una contribución importante, "dice Bernhard Landwehrmeyer, el Director de la Clínica para Pacientes Ambulatorios Huntington del Departamento de Neurología del Centro Médico Universitario de Ulm.