Si queremos frenar el calentamiento global, debemos reducir drásticamente las emisiones de gases de efecto invernadero. Entre otras cosas, debemos prescindir de los combustibles fósiles y utilizar tecnologías más eficientes energéticamente.
Sin embargo, la reducción de emisiones por sí sola no será suficiente para cumplir los objetivos climáticos. También debemos capturar grandes cantidades del gas de efecto invernadero CO2 de la atmósfera y almacenarlo permanentemente bajo tierra o utilizarlo como material de alimentación neutro en carbono en la industria. Desafortunadamente, las tecnologías de captura de carbono disponibles hoy en día requieren mucha energía y, en consecuencia, son caras.
Por este motivo, los investigadores de la ETH Zurich están desarrollando un nuevo método que utiliza luz. Con este proceso, en el futuro la energía necesaria para la captura de carbono procederá del sol. Su trabajo ha sido publicado en Química de Materiales .
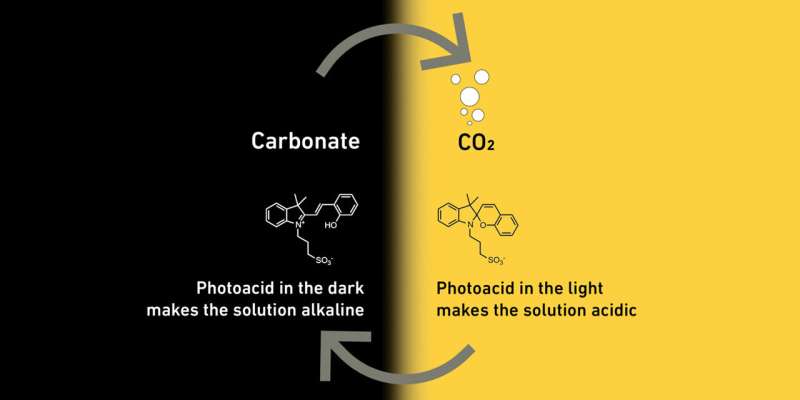
Dirigidos por Maria Lukatskaya, profesora de sistemas de energía electroquímica, los científicos están explotando el hecho de que en líquidos acuosos ácidos, el CO2 está presente como CO2 , pero en líquidos acuosos alcalinos reacciona para formar sales de ácido carbónico, conocidas como carbonatos. Esta reacción química es reversible. La acidez de un líquido determina si contiene CO2 o un carbonato.
Para influir en la acidez de su líquido, los investigadores le agregaron moléculas, llamadas fotoácidos, que reaccionan a la luz. Si luego se irradia dicho líquido con luz, las moléculas lo vuelven ácido. En la oscuridad, vuelven al estado original que hace que el líquido sea más alcalino.
Así funciona en detalle el método de los investigadores de ETH:los investigadores separan el CO2 del aire haciendo pasar el aire a través de un líquido que contiene fotoácidos en la oscuridad. Como este líquido es alcalino, el CO2 reacciona y forma carbonatos. Tan pronto como las sales del líquido se han acumulado en un grado significativo, los investigadores irradian el líquido con luz. Esto lo vuelve ácido y los carbonatos se transforman en CO2. .
El CO2 Burbujas del líquido, tal como lo hace en una botella de cola, y se puede recolectar en tanques de gasolina. Cuando apenas hay CO2 dejado en el líquido, los investigadores apagan la luz y el ciclo comienza de nuevo, con el líquido listo para capturar CO2 .
Sin embargo, en la práctica surgió un problema:los fotoácidos utilizados son inestables en el agua. "Durante nuestros primeros experimentos, nos dimos cuenta de que las moléculas se descompondrían al cabo de un día", afirma Anna de Vries, estudiante de doctorado en el grupo de Lukatskaya y autora principal del estudio.
Entonces Lukatskaya, de Vries y sus colegas analizaron la desintegración de la molécula. Resolvieron el problema realizando su reacción no en agua sino en una mezcla de agua y un disolvente orgánico. Los científicos pudieron determinar la proporción óptima de los dos líquidos mediante experimentos de laboratorio y pudieron explicar sus hallazgos gracias a cálculos modelo realizados por investigadores de la Universidad de la Sorbona en París.
Por un lado, esta mezcla les permitió mantener estables las moléculas de fotoácido en la solución durante casi un mes. Por otro lado, aseguró que se pudiera usar la luz para alternar la solución según fuera necesario entre ácida y alcalina. Si los investigadores utilizaran el disolvente orgánico sin agua, la reacción sería irreversible.
Otros procesos de captura de carbono también son cíclicos. Un método establecido funciona con filtros que recogen el CO2 moléculas a temperatura ambiente. Para eliminar posteriormente el CO2 de los filtros, estos deben calentarse a unos 100° Celsius. Sin embargo, la calefacción y la refrigeración consumen mucha energía:representan la mayor parte de la energía requerida por el método de filtrado.
"Por el contrario, nuestro proceso no necesita calefacción ni refrigeración, por lo que requiere mucha menos energía", afirma Lukatskaya. Más que eso, el nuevo método de los investigadores de ETH potencialmente funciona solo con la luz solar.
"Otro aspecto interesante de nuestro sistema es que podemos pasar de alcalino a ácido en segundos y volver a alcalino en minutos. Eso nos permite cambiar entre captura y liberación de carbono mucho más rápidamente que en un sistema controlado por temperatura", explica de Vries.
Con este estudio, los investigadores han demostrado que los fotoácidos se pueden utilizar en el laboratorio para capturar CO2 . El próximo paso hacia la madurez en el mercado será aumentar aún más la estabilidad de las moléculas de fotoácidos. También necesitan investigar los parámetros de todo el proceso para optimizarlo aún más.
Más información: Anna de Vries et al, Fotoácido sintonizado por solvatación como interruptor de pH estable impulsado por luz para la captura y liberación de CO2, Química de materiales (2023). DOI:10.1021/acs.chemmater.3c02435
Información de la revista: Química de los Materiales
Proporcionado por ETH Zurich