Investigadores de la Universidad de California en Irvine han descubierto profundas similitudes y sorprendentes diferencias entre humanos e insectos en la producción de la molécula crítica de la retina que absorbe la luz, 11-cis-retinal, también conocida como "cromóforo visual". Los hallazgos profundizan la comprensión de cómo las mutaciones en la enzima RPE65 causan enfermedades de la retina, especialmente la amaurosis congénita de Leber, una devastadora enfermedad que ciega a los niños.
Para el estudio, publicado recientemente en la revista Nature Chemical Biology , el equipo utilizó cristalografía de rayos X para estudiar NinaB, una proteína que se encuentra en los insectos y que funciona de manera similar a la proteína RPE65 que se encuentra en los humanos. Ambos son cruciales para la síntesis de 11-cis-retinal y su ausencia provoca una discapacidad visual grave.
"Nuestro estudio desafía las suposiciones tradicionales sobre las similitudes y diferencias de la visión humana y de los insectos", dijo el autor correspondiente Philip Kiser, profesor asociado de fisiología y biofísica, así como de oftalmología de la UCI. "Si bien estas enzimas comparten un origen evolutivo común y una arquitectura tridimensional, descubrimos que el proceso por el cual producen 11-cis-retinal es distinto".
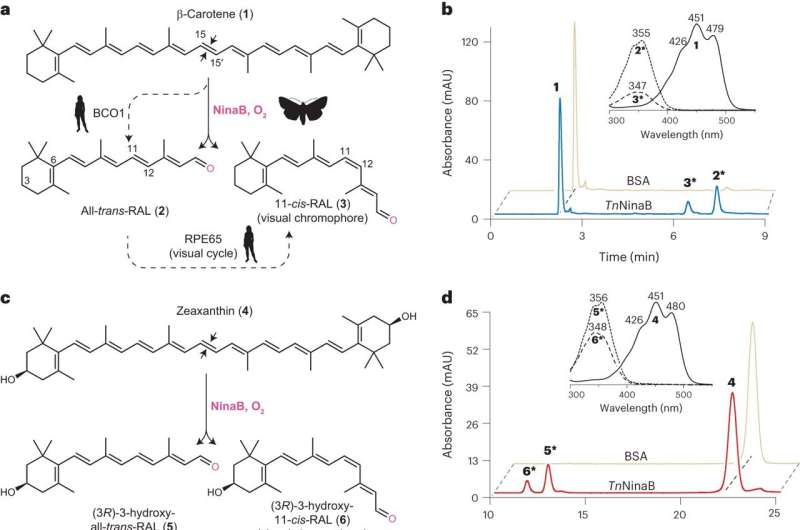
La creación de 11-cis-retinal comienza con el consumo de alimentos como zanahorias o calabazas que contienen compuestos utilizados para la generación de vitamina A, como el betacaroteno. Estos nutrientes son metabolizados por enzimas de escisión de carotenoides, incluidas NinaB y RPE65.
Anteriormente se sabía que los humanos necesitan dos de estas enzimas para producir 11-cis-retinal a partir de betacaroteno, mientras que los insectos pueden lograr la conversión solo con NinaB. Una motivación clave para el estudio fue obtener información sobre cómo NinaB puede combinar los dos pasos en una sola reacción junto con las relaciones funcionales entre NinaB y RPE65.
"Descubrimos que estructuralmente estas enzimas son muy parecidas, pero los lugares en los que realizan su actividad son diferentes", dijo la autora principal, Yasmeen Solano, estudiante de posgrado en el laboratorio de Kiser en el Centro de Investigación de la Visión Traslacional de la UCI.
"La comprensión de las características clave dentro de la estructura de NinaB ha llevado a una mejor comprensión de la maquinaria catalítica necesaria para respaldar la función de los pigmentos visuales de la retina. A través de nuestro estudio de NinaB, pudimos aprender sobre la estructura de una porción clave de RPE65 que no se había resuelto previamente. Este descubrimiento es vital para comprender y abordar las mutaciones de pérdida de función en RPE65".
Otros miembros del equipo incluyeron a Michael Everett, un especialista junior en el laboratorio de Kiser, y Kelly Dang y Jude Abueg, estudiantes universitarios de ciencias biológicas en ese momento.
Más información: Yasmeen J. Solano et al, Las enzimas de escisión de carotenoides evolucionaron de manera convergente para generar el cromóforo visual, Nature Chemical Biology (2024). DOI:10.1038/s41589-024-01554-z
Proporcionado por la Universidad de California, Irvine