Aunque es posible que nunca haya oído hablar de la superfamilia de enzimas del citocromo P450, estas proteínas desempeñan funciones diversas y críticas en los seres humanos a través del procesamiento metabólico de medicamentos, pesticidas, ácidos grasos, vitaminas liposolubles y carcinógenos químicos y la biosíntesis de esteroides esenciales. incluidos los esteroles.
Los esteroles son una familia de compuestos químicos que comparten una estructura central anular y que son fundamentales para la vida de una multitud de organismos. El esterol más conocido en los seres humanos es el colesterol, un componente clave de nuestra membrana celular y un elemento siempre presente en la mente de los médicos, ya que los niveles elevados de colesterol en sangre pueden aumentar nuestro riesgo de enfermedad cardiovascular.
El laboratorio de Fred Guengerich, el Tadashi Inagami, Ph.D. Profesor de Bioquímica en la Universidad de Vanderbilt, ha estudiado los citocromos P450 durante 50 años. En un nuevo artículo publicado en Angewandte Chemie , el laboratorio de Guengerich investigó el mecanismo utilizado por el citocromo P450 51 (una enzima P450 presente en todas las familias de la vida) para catalizar una reacción crítica de tres pasos en la biosíntesis de esteroles:el metabolismo del lanosterol.
"Este ha sido un proyecto desafiante pero gratificante que proporciona la primera respuesta inequívoca a una pregunta mecanicista controvertida y de larga data en la biosíntesis de esteroles eucarióticos", dijo el autor principal y estudiante graduado en bioquímica Kevin McCarty.
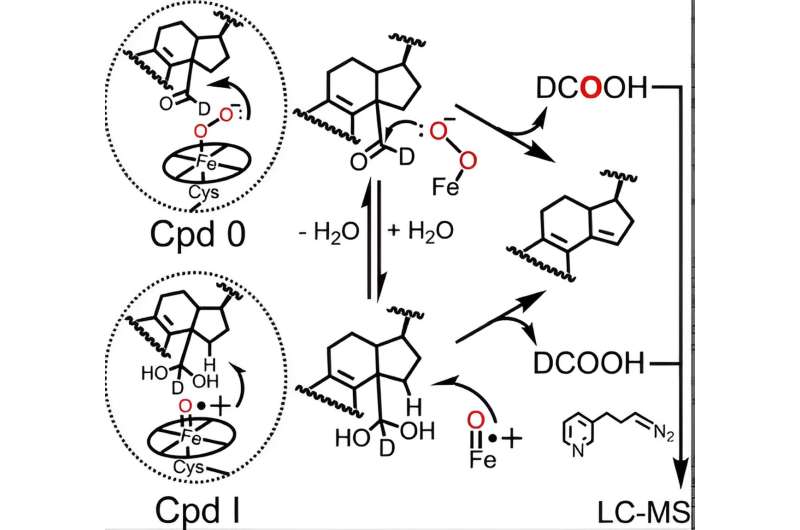
El ciclo catalítico de todas las enzimas P450 implica la formación de dos especies activas de hierro hemo (Compuesto 0 y Compuesto I, el último de los cuales se forma naturalmente a partir del Compuesto 0) que son necesarias para las reacciones catalizadas por P450, incluido el metabolismo del lanosterol. Aunque el papel del Compuesto I en los dos primeros pasos del metabolismo del lanosterol está bien establecido, los datos contradictorios de varios laboratorios no han dejado claro a los científicos si P450 51 utiliza el Compuesto 0 o el Compuesto I para lograr el paso final crucial.
Mediante el uso de una técnica analítica avanzada refinada inicialmente por el ex postdoctorado de Guengerich, Francis Yoshimoto, que rastrea la incorporación de un isótopo de oxígeno llamado 18 O en los productos de la reacción P450, McCarty y sus colegas se han convertido en los primeros en sugerir que tanto el Compuesto 0 como el Compuesto I pueden desempeñar funciones químicas activas en el último paso del metabolismo del lanosterol.
De hecho, los resultados presentados en el Angewandte Chemie El artículo indica que, si bien el Compuesto 0 es la principal especie hemo responsable del último paso de la acción catalítica del P450 51 humano (~85% de la reacción), el Compuesto I todavía desempeña un papel menor y cuantificable (~14% de la reacción). /P>
En colaboración con Galina Lepesheva, profesora de investigación de bioquímica, los investigadores compararon las contribuciones relativas de cada especie de hemo en cuatro enzimas P450 51 de levaduras patógenas, amebas y tripanosomas, un tipo de parásito, al ortólogo humano. Mientras que las enzimas de levadura y ameba mostraron resultados similares a los de la proteína humana, los resultados de las enzimas tripanosómicas revelaron una diferencia mecanística interesante:el Compuesto 0 y el Compuesto I compartieron contribuciones aproximadamente iguales a la reacción.
Estos resultados añaden profundidad a nuestra comprensión colectiva y mecanicista de las enzimas P450, específicamente aquellas involucradas en la biosíntesis de esteroles.
"Este fue un proyecto largo que requirió una síntesis química de 17 pasos, cinco enzimas P450 51 purificadas diferentes de nuestra colaboradora la profesora Galina Lepesheva, una atención muy cuidadosa al uso de una atmósfera de 18 oxígeno en las reacciones, una sofisticada espectrometría de masas de alta resolución, y cuidadoso trabajo de todos los autores en nuestro laboratorio", dijo Guengerich. Según él, la atención de su equipo al detalle le permitió "descifrar este sistema" y proporcionar un análisis claro de un mecanismo enzimático bifurcado.
"Nuestros hallazgos proporcionan un avance importante en la comprensión de la función de P450 51 en humanos y en diversos patógenos, que esperamos sean útiles en la búsqueda continua de fármacos dirigidos a P450 51", afirmó McCarty.
Actualmente, varios fármacos antimicóticos existentes inhiben las enzimas fúngicas P450 51 para interferir con la capacidad del organismo para producir esteroles esenciales y reproducirse. Sin embargo, la resistencia a los antimicóticos, junto con la existencia de infecciones fúngicas potencialmente mortales para las que no existe tratamiento, subraya la necesidad continua de nuevos fármacos dirigidos a P450 51.
De cara al futuro, los laboratorios Guengerich y Lepesheva analizarán más a fondo una enzima P450 51 de ameba en busca de peculiaridades mecanísticas que puedan explotarse como posibles objetivos farmacológicos.
Más información: Kevin D. McCarty et al, El etiquetado con oxígeno 18 revela un mecanismo mixto de Fe-O en el último paso de la desmetilación del citocromo P450 51 esterol 14α, Angewandte Chemie International Edition (2024). DOI:10.1002/anie.202317711
Proporcionado por la Universidad de Vanderbilt