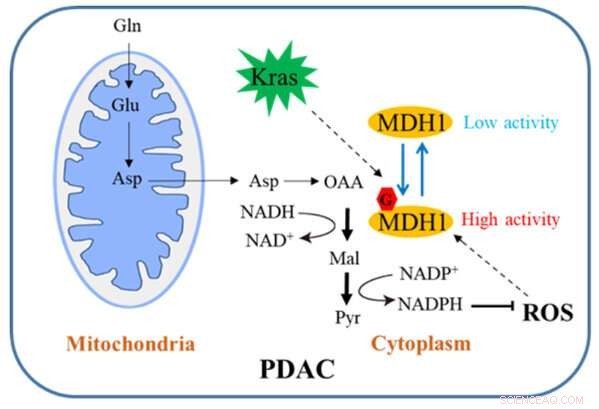
Diagrama esquemático de cómo la glicosilación de MDH1 regula el crecimiento de PDAC. Crédito:Universidad de Zhejiang
El cáncer de páncreas es un tumor extremadamente maligno en el sistema digestivo, y su tasa de supervivencia a cinco años es poco más del 10%. Las alteraciones metabólicas son una de las características de las células tumorales. Las células de adenocarcinoma ductal pancreático (PDAC) oncogénicas activadas por Kras dependen en gran medida de una vía catabólica de glutamina (Gln) no convencional para sostener el crecimiento celular.
En la vía convencional, Gln se convierte primero en aspartato (Asp), que se transporta desde las mitocondrias al citosol, donde se convierte secuencialmente por la aspartato transaminasa 1 (GOT1), MDH1 y la enzima málica 1 (ME1) en piruvato y NADPH. Esta vía es crítica para que las células PDAC mantengan la homeostasis redox y es necesaria para la proliferación celular y el crecimiento tumoral in vivo. Por lo tanto, una comprensión profunda de este mecanismo regulador bien puede abrir una nueva vía para el tratamiento clínico de PDAC.
El equipo de investigación dirigido por el Prof. Zhou Ruhong y el Prof. Yi Wen de la Facultad de Ciencias de la Vida de la Universidad de Zhejiang publicó un artículo en la revista Nature Chemical Biology el 25 de julio. Este artículo revela que la O-GlcNAcilación contribuye al crecimiento del cáncer de páncreas al regular la actividad metabólica de la malato deshidrogenasa 1 (MDH1). Este hallazgo tiene inmensas implicaciones para el desarrollo de fármacos para el tumor pancreático.
El equipo ha llevado a cabo investigaciones relevantes. Su estudio demuestra que la mutación de Kras induce la β-N-acetilglucosamina ligada a O (O-GlcNAc) celular, una forma frecuente de glicosilación de proteínas. La malato deshidrogenasa 1 (MDH1), una enzima clave en la vía catabólica de la glutamina, está regulada positivamente por la O-GlcNAcilación en la serina 189 (S189).
Las simulaciones de dinámica molecular sugieren que la glicosilación de S189 en MDH1 monomérico mejora la estabilidad del bolsillo de unión al sustrato y fortalece las interacciones del sustrato al servir como un pegamento molecular. El agotamiento de O-GlcNAcylation reduce la actividad de MDH1, altera el metabolismo de la glutamina, sensibiliza las células PDAC al estrés oxidativo, disminuye la proliferación celular e inhibe el crecimiento tumoral en ratones desnudos. Además, los niveles de O-GlcNAcylation de MDH1 están elevados en muestras clínicas de PDAC.
La identificación de vías y proteínas específicas con dependencia única de O-GlcNAc es indispensable para desarrollar terapias dirigidas. El estudio del Prof. Zhou y el Prof. Yi et al. revela que la glicosilación de MDH1 está preparada para regular la vía metabólica Gln única en PDAC, lo que destaca el potencial para intervenir en la glicosilación de MDH1 como estrategia terapéutica contra PDAC. Científicos descubren molécula que mata células de cáncer de páncreas