Comprender el comportamiento de la materia es crucial para avanzar en campos científicos como la biología, la química y la ciencia de los materiales. La cristalografía de rayos X ha sido fundamental en esta búsqueda, permitiendo a los científicos determinar estructuras moleculares con precisión.
En los experimentos tradicionales de cristalografía de rayos X, un solo cristal se expone a rayos X varias veces para obtener señales de difracción. Esto plantea un problema cuando la estructura de la muestra se altera o daña por la exposición a los rayos X.
En los últimos años, los avances tecnológicos han permitido el desarrollo de la "cristalografía de femtosegundos en serie con resolución temporal" (TR-SFX). En la cristalografía en serie, un cristal se expone a los rayos X solo una vez, lo que permite medir la muestra en el mejor estado posible donde el cristal no resulta dañado por los rayos X. Luego, esto se combina con la popular técnica de resolución temporal, que permite seguir los cambios estructurales de las moléculas en los cristales en tiempo real durante una reacción.
Sin embargo, hasta ahora TR-SFX solo se ha limitado al estudio de muestras de proteínas. Si el uso de TR-SFX se puede extender a muestras no proteicas, se desbloquearán oportunidades para investigar el movimiento en tiempo real en una gama más amplia de materiales, incluidos aquellos cruciales para semiconductores y baterías.
Por primera vez, investigadores dirigidos por el director IHEE Hyotcherl del Centro de Dinámica de Reacción Avanzada del Instituto de Ciencias Básicas (IBS) han aplicado TR-SFX a un sistema distinto de las proteínas. El trabajo ha sido publicado en Nature Chemistry .
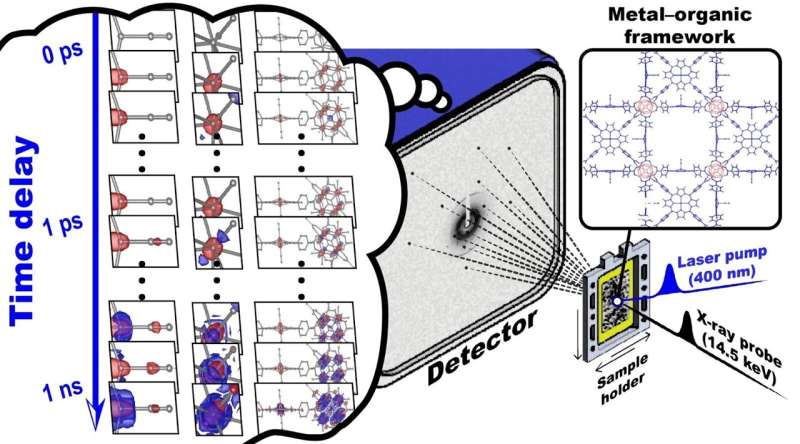
El material que eligieron fue una muestra llamada red de coordinación porosa–224(Fe), PCN–224(Fe), para demostrar la viabilidad de la cristalografía en serie a nivel molecular, permitiéndoles observar el movimiento molecular en tiempo real con resolución atómica. /P>
La muestra consta de monóxido de carbono (CO) adsorbido en derivados de porfirina de hierro (porfirina Fe) y grupos de circonio (Zr) repetidos en una estructura organometálica.
La razón por la que TR-SFX se limitaba anteriormente a estudiar únicamente muestras de proteínas era que se requieren estándares mucho más altos para evaluar las estructuras de muestras no proteicas. Por lo tanto, el equipo de IBS tuvo que mejorar en gran medida la especificación de la cristalografía para cumplir con estos altos criterios.
La configuración del equipo reveló la estructura cristalina en un total de 33 puntos de tiempo que van desde 100 femtosegundos a 3 nanosegundos (10 -9 segundos). Este es un avance con respecto a estudios TR-SFX anteriores de las proteínas, que generalmente informan estructuras cristalinas en solo aproximadamente 10 puntos de tiempo. Este aumento sustancial en la resolución temporal, casi tres veces mayor que estudios anteriores sobre proteínas, permitió una representación más precisa de los cambios estructurales durante un largo período de tiempo.
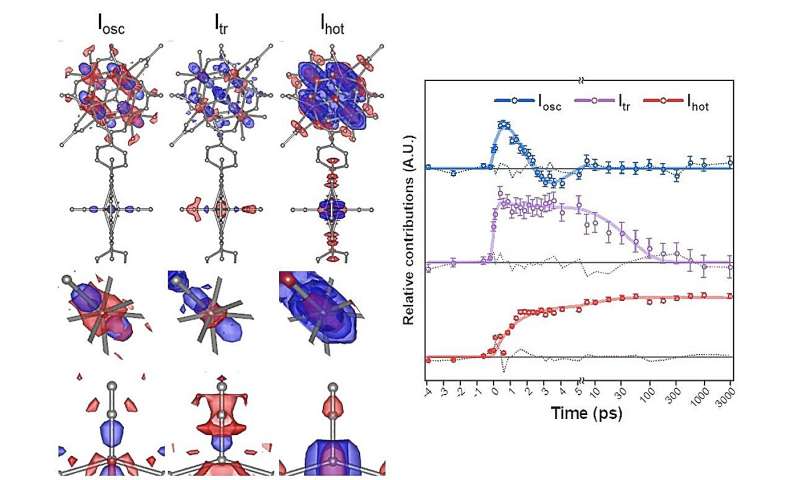
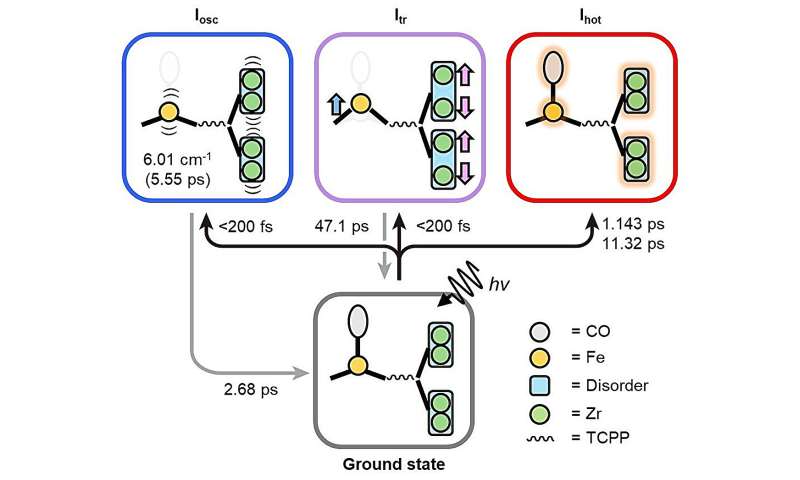
Cuando el PCN-224 (Fe) se irradia con luz, el CO adsorbido en la porfirina de Fe se disocia, iniciando una cascada de cambios estructurales. Utilizando el TR-SFX mejorado, los investigadores pudieron observar estos cambios estructurales con un detalle sin precedentes, con una resolución de femtosegundos de 10 -15 segundos y una resolución atómica de 10 -10 metros (o angstroms).
Pudieron identificar tres vías diferentes de cambio estructural:doming, el movimiento de los átomos de hierro en las porfirinas de hierro fuera del plano de las porfirinas; modo fonón de átomos de circonio y hierro; y movimiento vibratorio aleatorio al aumentar la temperatura.
Con este estudio, los investigadores han demostrado que es posible aplicar mediciones TR-SFX a sistemas químicos, un importante paso adelante para demostrar la practicidad de la técnica.
El estudio marca un hito importante para la comunidad científica, ya que es la primera vez que se observa el comportamiento molecular en tiempo real mediante cristalografía en serie. Utilizando TR-SFX, una técnica que proporciona una alta resolución espaciotemporal, el equipo pudo capturar cambios estructurales diminutos en moléculas de estado sólido en tiempo real.
El director Ihee del Centro de Dinámica de Reacción Molecular Avanzada dijo:"Dado que los avances técnicos y los métodos analíticos propuestos en este estudio pueden usarse ampliamente para observar muchas otras reacciones de fase cristalina de varios sistemas moleculares, esta investigación no solo abre nuevos horizontes en el campo de la investigación de estructuras moleculares, pero también tiene infinitas aplicaciones en futuros descubrimientos científicos."
Más información: Estructuras dinámicas en 3D de una estructura organometálica capturadas con cristalografía en serie de femtosegundos, Nature Chemistry (2024). DOI:10.1038/s41557-024-01460-w
Información de la revista: Química de la naturaleza
Proporcionado por el Instituto de Ciencias Básicas