La pandemia de COVID-19 provocó millones de muertes. A pesar de un esfuerzo de investigación colaborativo incomparable que condujo a la producción de vacunas y terapias efectivas en un tiempo récord, todavía falta una comprensión completa de la estructura y el ciclo de vida del coronavirus conocido como SARS-CoV-2.
Los científicos utilizaron los biolaboratorios y el instrumento SPB/SFX del XFEL europeo para estudiar la proteasa principal, o Mpro, del virus y comprender cómo se protege del daño oxidativo. Los resultados añaden conocimientos clave a nuestra comprensión del funcionamiento del SARS-CoV-2 y el campo de la biología viral.
El artículo se publica en la revista Nature Communications. .
Entre enero de 2020 y marzo de 2023, más de seis millones de personas murieron como consecuencia de la enfermedad respiratoria COVID-19 y varios cientos de millones resultaron infectados. La enfermedad es causada por el SARS-CoV-2, un coronavirus.
"Los coronavirus son un grupo de virus de ARN que causan enfermedades en mamíferos y aves", explica el científico europeo de XFEL Richard Bean. "Sin embargo, a pesar de su importante relevancia para la salud humana mundial, todavía queda mucho que aprender sobre la estructura y función de los coronavirus en general y del SARS-CoV-2 en particular".
En respuesta al estallido de la pandemia, científicos y organizaciones científicas de todo el mundo se esforzaron en estudiar la estructura, dinámica y función del SARS-CoV-2 en busca de vacunas y terapias. Debido a su papel central en el ciclo de replicación del virus, la proteasa principal, una enzima que libera entre sí las partes recién creadas del virus, pronto surgió como un objetivo clave para los fármacos antivirales.
La proteasa principal, o Mpro, es particularmente atractiva para el desarrollo de fármacos porque desempeña un papel central en la replicación viral y también porque es bastante diferente de todas las proteínas humanas. Esto permite que las terapias se dirijan específicamente al virus y al mismo tiempo minimicen los efectos secundarios que podrían dañar a los pacientes. Los programas anteriores de descubrimiento de fármacos dirigidos a otros virus han tenido éxito utilizando inhibidores de la proteasa viral, lo que hace más probable un resultado exitoso en el caso del SARS-CoV-2.
"Aunque el apogeo de la pandemia de COVID-19 ya ha pasado, el estudio del virus SARS-CoV-2 todavía tiene mucho valor", afirma Thomas Lane, del Centro de Ciencia del Láser de Electrones Libres (CFEL) en Hamburgo. "La COVID sigue presentando una importante amenaza para la salud en todo el mundo. Dada la persistencia de este virus y la posible aparición de futuros coronavirus patógenos, es imperativo que desarrollemos una comprensión más profunda de Mpro y su papel en la función viral".
En un experimento reciente con el instrumento SPB/SFX en el XFEL europeo, Lane y sus colegas utilizaron el intenso haz de rayos X para estudiar Mpro. Varios estudios estructurales previos centrados en Mpro han puesto de relieve una serie de peculiaridades.
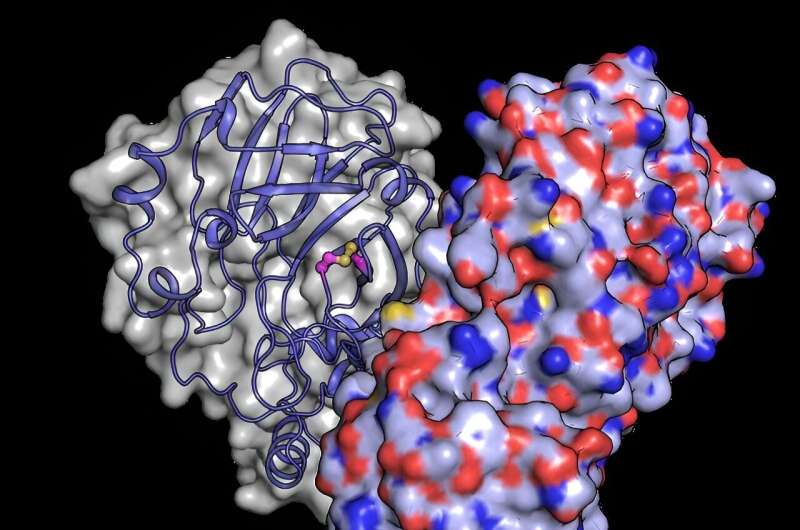
"En primer lugar, la proteína forma una estructura tridimensional conocida como dímero cuando se encuentra en altas concentraciones", explica el científico europeo del XFEL Robin Schubert, que participó en el experimento. "Este hábito estructural parece influir directamente en su actividad, pero no sabemos exactamente por qué es importante para el virus". Además de información clave sobre la estructura 3D, estudios recientes también han insinuado la importancia de los niveles de oxígeno celular para la actividad de la proteasa.
"Parece que incluso una exposición leve al oxígeno disminuye la actividad de Mpro", explica Patrick Reinke, también del CFEL. De hecho, en presencia de suficiente oxígeno, el recambio cesa por completo. Pero este proceso es reversible:si se elimina el oxígeno, la enzima se reactiva, lo que sugiere que el sistema ha desarrollado mecanismos protectores para sobrevivir en un ambiente oxidativo.
"Se ha demostrado que el estrés oxidativo regula la función de otros virus, como el VIH", añade Reinke. "Se ha sugerido que los cambios estructurales en la proteasa le permiten escapar del daño oxidativo en ambientes ricos en oxígeno. Sin embargo, todavía no estamos seguros de cómo estos mecanismos protectores afectan la aptitud viral".
Para comprender mejor cómo los cambios estructurales protegen a la proteína del daño del oxígeno, el equipo utilizó el potente haz de rayos X del XFEL europeo para revelar la estructura de Mpro después de haber sido expuesta al oxígeno. Descubrieron una reordenación estructural de Mpro en la que se forma un enlace entre dos residuos de cisteína:el sitio activo cisteína C145 y una cisteína distal C117.
Para lograr esto, el equipo produjo grandes cantidades de Mpro durante varios meses en los biolaboratorios del XFEL europeo y lo convirtió en microcristales, algunos de los cuales se cultivaron en presencia de oxígeno. Finalmente, los microcristales fueron enviados volando frente al haz XFEL europeo en el instrumento SPB/SFX utilizando un chorro de líquido.
Es imposible estudiar cristales tan pequeños utilizando fuentes de luz tradicionales porque la cantidad de radiación necesaria para generar suficientes datos a partir de los cristales los destruiría. Sin embargo, los pulsos de rayos X producidos por el XFEL europeo son tan potentes y cortos que pueden usarse para capturar una imagen del cristal de proteína antes de que tenga tiempo de desintegrarse.
"Nuestros resultados muestran que el sitio activo cisteína, que conduce la química de la enzima, puede esconderse furtivamente del daño oxidativo", dice Schubert. Normalmente, la oxidación puede dañar irreversiblemente las cisteínas.
Sin embargo, tras la oxidación, Mpro protege su cisteína más importante formando lo que se conoce como "enlace disulfuro", que la entierra en el núcleo de la estructura proteica. Luego, si se regresa a un ambiente seguro y con poco oxígeno, el enlace disulfuro puede romperse, revelando la cisteína activa, que reanuda su función original.
"Los experimentos realizados en el XFEL europeo revelan una imagen de la proteína en su estado disulfuro oculto, confirmando su existencia y descubriendo cómo funciona", afirma Schubert.
"Mpro exhibe un conjunto inusualmente rico de modificaciones de oxidación, y nuestro experimento añade una pieza clave a esa historia", dice Lane. Los científicos están entusiasmados con lo que indican sus datos y con sus próximos pasos. "Mpro es un eje de la biología del coronavirus y el principal objetivo de las terapias de moléculas pequeñas anti-COVID-19.
"Se ha demostrado que la función de la enzima está regulada mediante dimerización y oxidación, y está claro que estos mecanismos reguladores están biofísicamente correlacionados. Si bien nuestras estructuras proporcionan información mecanicista sobre estas propiedades de Mpro, ahora debemos comprender cómo la regulación basada en el estrés oxidativo o La concentración de proteínas afectará la aptitud viral. Esto proporcionará una visión más profunda de la biología viral y, con suerte, abrirá nuevas oportunidades para alterar esa biología con medicamentos que preservan la vida".
Más información: Patrick Y. A. Reinke et al, SARS-CoV-2 Mpro responde a la oxidación formando enlaces disulfuro y NOS/SONOS, Nature Communications (2024). DOI:10.1038/s41467-024-48109-3
Información de la revista: Comunicaciones sobre la naturaleza
Proporcionado por XFEL europeo