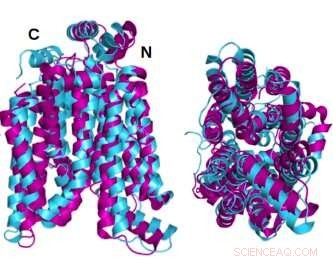
Dos ángulos de la proteína transportadora de glucosa de estructura cristalina GLUT1 (magenta) superpuesta con la variante soluble en agua predicha por computadora AlphaFold2 de la misma proteína (cian) demuestran que la proteína cristalina y su variante QTY soluble en agua comparten una notable similitud estructural. Crédito:Laboratorio Shuguang Zhang, MIT
Todas las membranas celulares del cuerpo humano tienen proteínas incrustadas que sirven como sensores, mensajeros o como medio de transporte y regulación de sustancias que entran y salen de la célula. Las proteínas de transporte en particular son poco conocidas debido a su complejidad estructural y su naturaleza hidrofóbica que las hace resistentes al estudio. Al mismo tiempo, estas proteínas de transporte, especialmente las que regulan la glucosa, juegan un papel vital en el crecimiento de los tumores cancerosos.
En un nuevo estudio, los científicos dirigidos por el Dr. Shuguang Zhang, Ph.D. del MIT Media Lab, demuestran un método para predecir rápidamente el diseño de estructuras variantes hidrofílicas de las 14 proteínas de membrana de transporte de glucosa en las células. Esto permitirá a los investigadores estudiar más fácilmente las proteínas en el agua. Los científicos confirman la precisión de las estructuras predichas comparándolas con imágenes cristalográficas preexistentes de dos de las proteínas.
Esperan que una mejor comprensión de estas proteínas transportadoras de glucosa acelere el desarrollo de anticuerpos monoclonales terapéuticos para tratar la metástasis del cáncer. Esto esencialmente mataría de hambre a las células cancerosas al bloquear los transportadores de glucosa.
"La mayoría de las células cancerosas aumentan significativamente su expresión y producción de transportadores de glucosa, llamados GLUT, por su insaciable demanda de energía", dice Eva Smorodina, estudiante de pregrado en biología estructural en el Laboratorio Greiff de la Universidad de Oslo, quien es el primer autor de un artículo sobre el estudio publicado el 27 de junio en QRB Discovery . "Actualmente, casi no hay medicamentos efectivos para bloquear los GLUT, ya que tienen una estructura desafiante".
Las estructuras complejas de los GLUT comprenden 12 hélices hidrofóbicas transmembrana incrustadas en la membrana. En su estado nativo o cristalino, las estructuras hidrofóbicas deben colocarse en un detergente o reactivo especial para estudio de laboratorio, o pierden su estructura. Y con las proteínas, la estructura y la función están indeleblemente relacionadas.
"Estudiar estas proteínas en detergente es como usar guantes gruesos para ensamblar un reloj costoso o tocar un violín", dice el Dr. Zhang, uno de los pocos científicos biomédicos para quienes el estudio de las proteínas de membrana es tan convincente como vital para nuestra comprensión. de células cancerosas. Comenzó a trabajar en proteínas de membrana a principios de la década de 2000. "Pocas personas estaban estudiando estas proteínas de membrana", dice el Dr. Zhang. "Son como una patata caliente", dice, debido a su inherente resistencia al estudio.
El nuevo trabajo se basa en el éxito del Dr. Zhang hace cuatro años, cuando él y un equipo lograron lo que el Dr. Zhang había estado trabajando durante casi una década:diseñaron un método maravillosamente simple llamado código QTY para transformar una proteína de membrana celular hidrofóbica. en una proteína hidrófila mediante la sustitución de muchos aminoácidos hidrófobos.
El código QTY lleva el nombre de los símbolos de los tres aminoácidos (glutamina (Q), treonina (T) y tirosina (Y)) que sustituyen a cuatro aminoácidos hidrofóbicos:leucina (L), isoleucina (I), valina ( V) y fenilalanina (F). Ninguno de estos aminoácidos lleva carga, lo que hace que la sustitución sea benigna. La estructura es esencial para el funcionamiento de las proteínas y la sustitución no altera la estructura.
En el último estudio, el Dr. Zhang y su equipo aplican el código QTY a las 14 proteínas de membrana transportadoras de glucosa que transportan el azúcar a las células. Utilizaron el nuevo programa AlphaFold2, un programa computacional basado en inteligencia artificial desarrollado por la empresa DeepMind, que puede predecir con precisión y rapidez cómo se pliegan las proteínas. El Dr. Zhang y su equipo utilizaron el código QTY con AlphaFold2 de código abierto para predecir las formas helicoidales alfa de las 14 proteínas GLUT tanto en sus formas hidrofóbicas naturales como en sus formas solubles en agua alteradas con el código QTY.
Las estructuras de estado nativo o cristalino de dos de los GLUT, 1 y 3, habían sido reveladas previamente por otros investigadores utilizando cristalografía de rayos X. Para corroborar su propia metodología, el equipo del Dr. Zhang primero predijo la estructura hidrofílica de esos dos GLUT aplicando los reemplazos de aminoácidos del código QTY y dejando que AlphaFold2 predijera las formas de las proteínas. Lo hizo con gran precisión. Las imágenes hidrofóbicas e hidrofílicas superpuestas son casi idénticas.
El equipo siguió esta confirmación combinando el código QTY y AlphaFold2 para predecir las estructuras hidrofílicas de los otros 12 GLUT, en un tiempo récord. "En 2018, tomó de cuatro a cinco semanas usar un grupo de computadoras de alta velocidad para simular cualquier estructura de proteína", dice el Dr. Zhang. "Ahora, con AlphaFold2, podemos usar una computadora de Google de forma gratuita y simula las proteínas transmembrana en horas. Algunas proteínas pequeñas tardaron menos de una hora".
"Este estudio sobre los transportadores de glucosa de membrana humana y sus variantes CANTIDAD solubles en agua del laboratorio de Zhang en el MIT es fascinante", dice el profesor Joel Sussman del Instituto de Ciencias Weizmann en Rehovot, Israel, que no participó en el trabajo. "Proporciona visualización experimental a través de cristalografía de rayos X y predicción de IA usando AlphaFold2 para ver, por primera vez, con resolución atómica, las diferencias entre las hélices hidrofóbicas 'que odian el agua' y las hélices hidrofílicas 'que aman el agua'. Es un paso en el uso del método de código QTY para estudiar proteínas transmembrana multispan y otras proteínas agregadas a través de sus variantes solubles en agua, y es probable que tenga un enorme impacto en el campo de la biotecnología".
El profesor del MIT Robert Langer, cuyo trabajo en ingeniería biomédica es muy celebrado, dice:"El [Descubrimiento QRB ] el artículo es excelente y creo que tiene el potencial de ayudar a muchos pacientes con cáncer". El profesor Langer no participó en la investigación.
Autores del Descubrimiento QRB papel son el Dr. Zhang y Smorodina; Fei Tao y Rui Qing de la Universidad Jiaotong de Shanghái (el Dr. Qing fue anteriormente investigador postdoctoral en el Media Lab del MIT y luego científico investigador en el Instituto Koch para la Investigación Integral del Cáncer en el MIT); el Dr. Steve Yang, ex alumno del MIT ahora en PT Metiska Farma en Indonesia; y el Dr. David Jin, MD, Ph.D. de Avalon GloboCare Corp., quien animó al Dr. Zhang a aplicar el código QTY al estudio de las células cancerosas. Avalon GloboCare también financió la investigación.
El Dr. Jin dice que espera, pero esto no es parte del estudio actual, que las investigaciones futuras puedan alterar genéticamente las membranas de paso de la glucosa para desarrollar nuevos objetivos terapéuticos.
"Ahora nuestras únicas opciones para el tratamiento del cáncer son la cirugía, la quimioterapia o la terapia con moléculas pequeñas", dice el Dr. Jin. "En el futuro, puede ser posible tomar la célula T de un paciente, un componente del sistema inmunológico, y modificarla genéticamente en el laboratorio para que pueda funcionar casi como un sistema GPS de búsqueda de cáncer con capacidad para atacar tumores. " Los científicos alteran las proteínas de la membrana para que sean más fáciles de estudiar