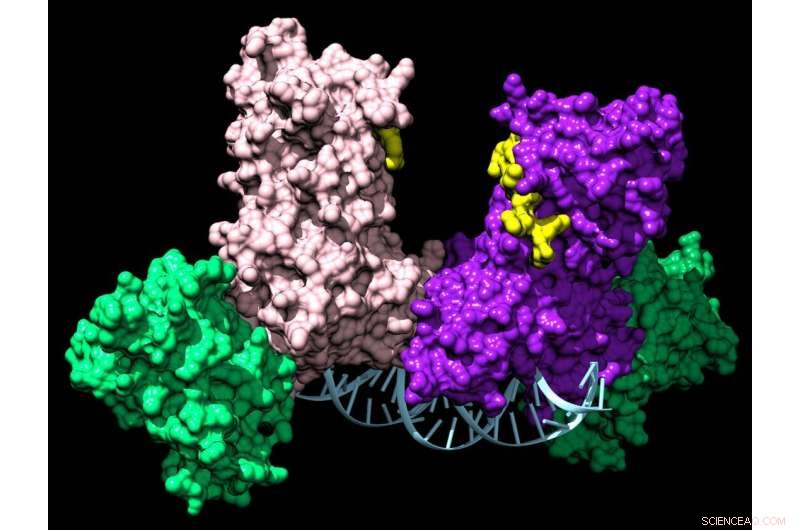
Un par de enzimas DNMT3A se unen a dos proteínas auxiliares (verde) para formar un complejo de cuatro partes que viaja a lo largo del ADN agregando etiquetas químicas que le indican a una célula qué genes expresar. Crédito:Jonathan Sandoval et al.
La quimioterapia apesta. Los tratamientos generalmente tienen efectos secundarios terribles, y no es ningún secreto que los medicamentos involucrados a menudo son tóxicos para el paciente, así como para su cáncer. La idea es que, dado que los cánceres crecen tan rápido, la quimioterapia acabará con la enfermedad antes de que sus efectos secundarios maten al paciente. Es por eso que los científicos y los médicos buscan constantemente terapias más efectivas.
Un equipo dirigido por investigadores de la UC Santa Bárbara, que incluye a colaboradores de la UC San Francisco y el Baylor College of Medicine, identificó dos compuestos que son más potentes y menos tóxicos que las terapias actuales contra la leucemia. Las moléculas funcionan de manera diferente a los tratamientos estándar contra el cáncer y podrían formar la base de una clase de medicamentos completamente nueva. Además, los compuestos ya se usan para tratar otras enfermedades, lo que reduce drásticamente la cantidad de trámites burocráticos necesarios para adaptarlos a la leucemia o incluso recetarlos fuera de etiqueta. Los hallazgos aparecen en el Journal of Medicinal Chemistry .
"Nuestro trabajo en una enzima que está mutada en pacientes con leucemia ha llevado al descubrimiento de una forma completamente nueva de regular esta enzima, así como nuevas moléculas que son más efectivas y menos tóxicas para las células humanas", dijo el profesor distinguido de UC Santa Barbara. Norbert Reich, autor correspondiente del estudio.
El epigenoma
Todas las células de su cuerpo contienen el mismo ADN o genoma, pero cada una usa una parte diferente de este modelo según el tipo de célula que sea. Esto permite que diferentes células lleven a cabo sus funciones especializadas sin dejar de utilizar el mismo manual de instrucciones; esencialmente, solo usan diferentes partes del manual. El epigenoma le dice a las células cómo usar estas instrucciones. Por ejemplo, los marcadores químicos determinan qué partes se leen y dictan el destino real de una célula.
El epigenoma de una célula es copiado y preservado por una enzima (un tipo de proteína) llamada DNMT1. Esta enzima asegura, por ejemplo, que una célula hepática en división se convierta en dos células hepáticas y no en una célula cerebral.
Sin embargo, incluso en los adultos, algunas células necesitan diferenciarse en diferentes tipos de células de lo que eran antes. Por ejemplo, las células madre de la médula ósea son capaces de formar todos los diferentes tipos de células sanguíneas, que no se reproducen por sí mismas. Esto está controlado por otra enzima, DNMT3A.
Todo está muy bien hasta que algo sale mal con DNMT3A, lo que hace que la médula ósea se convierta en células sanguíneas anormales. Este es un evento primario que conduce a diversas formas de leucemia, así como a otros tipos de cáncer.
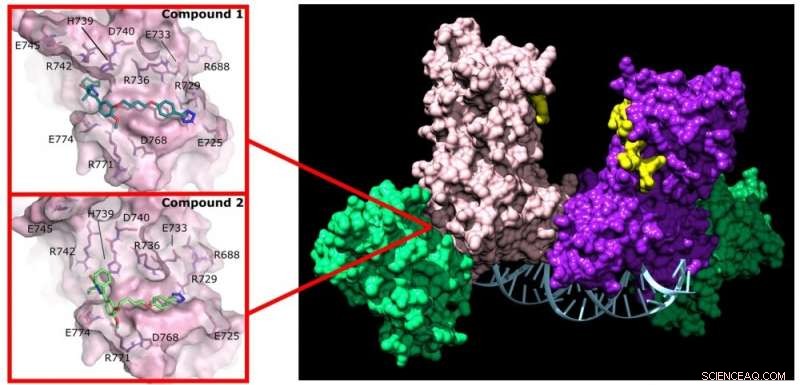
La pirazolona (compuesto 1) y la piridazina (compuesto 2) interrumpen la actividad de DNMT3A al unirse a un sitio no activo de la enzima. Crédito:Jonathan Sandoval et al.
Tratamientos tóxicos
La mayoría de los medicamentos contra el cáncer están diseñados para matar selectivamente las células cancerosas y dejar en paz a las células sanas. Pero esto es extremadamente desafiante, por lo que muchos de ellos son extremadamente tóxicos. Los tratamientos actuales contra la leucemia, como Decitabine, se unen a DNMT3A de una manera que lo desactiva, lo que ralentiza la progresión de la enfermedad. Lo hacen obstruyendo el sitio activo de la enzima (esencialmente, su fin comercial) para evitar que lleve a cabo su función.
Desafortunadamente, el sitio activo de DNMT3A es prácticamente idéntico al de DNMT1, por lo que el fármaco interrumpe la regulación epigenética en los 30 a 40 billones de células del paciente. Esto conduce a uno de los cuellos de botella más grandes de la industria farmacéutica:la toxicidad fuera del objetivo.
Obstruir el sitio activo de una proteína es una forma sencilla de desconectarla. Es por eso que el sitio activo suele ser el primer lugar que buscan los diseñadores de fármacos cuando diseñan nuevos fármacos, explicó Reich. Sin embargo, hace unos ocho años decidió investigar compuestos que pudieran unirse a otros sitios en un esfuerzo por evitar efectos no deseados.
Trabajando juntos
Mientras el grupo investigaba DNMT3A, notaron algo peculiar. Si bien la mayoría de estas enzimas relacionadas con la epigenética funcionan por sí solas, la DNMT3A siempre formaba complejos, ya sea consigo misma o con proteínas asociadas. Estos complejos pueden involucrar a más de 60 socios diferentes y, curiosamente, actúan como dispositivos de búsqueda para dirigir DNMT3A para controlar genes particulares.
Los primeros trabajos en el laboratorio del Reich, dirigidos por la exestudiante de posgrado Celeste Holz-Schietinger, demostraron que la alteración del complejo a través de mutaciones no interfería con su capacidad para agregar marcadores químicos al ADN. Sin embargo, el DNMT3A se comportó de manera diferente cuando estaba solo o en un par simple; no era para quedarse en el ADN y marcar un sitio tras otro, lo cual es esencial para su función celular normal.
Casi al mismo tiempo, el New England Journal of Medicine realizó una inmersión profunda en las mutaciones presentes en los pacientes con leucemia. Los autores de ese estudio descubrieron que las mutaciones más frecuentes en pacientes con leucemia mieloide aguda están en el gen DNMT3A. Sorprendentemente, Holz-Schietinger había estudiado exactamente las mismas mutaciones. El equipo ahora tenía un vínculo directo entre DNMT3A y los cambios epigenéticos que conducen a la leucemia mieloide aguda.
Descubriendo un nuevo tratamiento
Reich y su grupo se interesaron en identificar fármacos que pudieran interferir con la formación de complejos DNMT3A que se producen en las células cancerosas. Obtuvieron una biblioteca química que contenía 1500 fármacos previamente estudiados e identificaron dos que interrumpen las interacciones de DNMT3A con proteínas asociadas (inhibidores de proteína-proteína o IBP).
Además, estos dos medicamentos no se unen al sitio activo de la proteína, por lo que no afectan el trabajo de DNMT1 en todas las demás células del cuerpo. "Esta selectividad es exactamente lo que esperaba descubrir con los estudiantes en este proyecto", dijo Reich.
Estos medicamentos son más que un avance potencial en el tratamiento de la leucemia. Son una clase completamente nueva de medicamentos:inhibidores de proteína-proteína que se dirigen a una parte de la enzima lejos de su sitio activo. "Nunca antes se había hecho un PPI alostérico, al menos no para un objetivo de fármaco epigenético", dijo Reich. "Realmente puso una sonrisa en mi rostro cuando obtuvimos el resultado".
Este logro no es poca cosa. "El desarrollo de moléculas pequeñas que interrumpen las interacciones proteína-proteína ha demostrado ser un desafío", señaló el autor principal Jonathan Sandoval de UC San Francisco, ex estudiante de doctorado en el laboratorio de Reich. "Estos son los primeros inhibidores informados de DNMT3A que interrumpen las interacciones proteína-proteína".
Los dos compuestos que identificó el equipo ya se han utilizado clínicamente para otras enfermedades. Esto elimina una gran cantidad de costos, pruebas y burocracia involucrados en el desarrollo de terapias contra la leucemia. De hecho, los oncólogos podrían recetar estos medicamentos a los pacientes de forma no autorizada ahora mismo.
Construyendo sobre el éxito
Sin embargo, todavía hay más que entender sobre este nuevo enfoque. El equipo quiere aprender más sobre cómo los inhibidores proteína-proteína afectan los complejos DNMT3A en las células sanas de la médula ósea. Reich está colaborando con el profesor de química de UC Santa Barbara Tom Pettus y un estudiante de doctorado conjunto de ellos, Ivan Hernandez. "Estamos haciendo cambios en los medicamentos para ver si podemos mejorar aún más la selectividad y la potencia", dijo Reich.
También hay más que aprender sobre los efectos a largo plazo de los medicamentos. Debido a que los compuestos actúan directamente sobre las enzimas, es posible que no cambien las mutaciones subyacentes que causan el cáncer. Esta advertencia afecta la forma en que los médicos pueden usar estos medicamentos. "Un enfoque es que un paciente continúe recibiendo dosis bajas", dijo Reich. "Alternativamente, nuestro enfoque podría usarse con otros tratamientos, tal vez para reducir la carga tumoral hasta un punto en el que suspender el tratamiento sea una opción".
Reich también admite que el equipo aún tiene que saber qué efecto tienen los PPI en la diferenciación de la médula ósea a largo plazo. Tienen curiosidad por saber si los medicamentos pueden provocar algún tipo de memoria celular que podría mitigar los problemas a nivel epigenético o genético.
Dicho esto, Reich está animado por su descubrimiento. "Al no apuntar al sitio activo de DNMT3A, ya estamos mucho más allá del fármaco que se usa actualmente, Decitabine, que definitivamente es citotóxico", dijo, y agregó que este tipo de enfoque también podría adaptarse a otros tipos de cáncer. Los científicos encuentran un vínculo sorprendente entre el ADN mitocondrial y un mayor riesgo de aterosclerosis