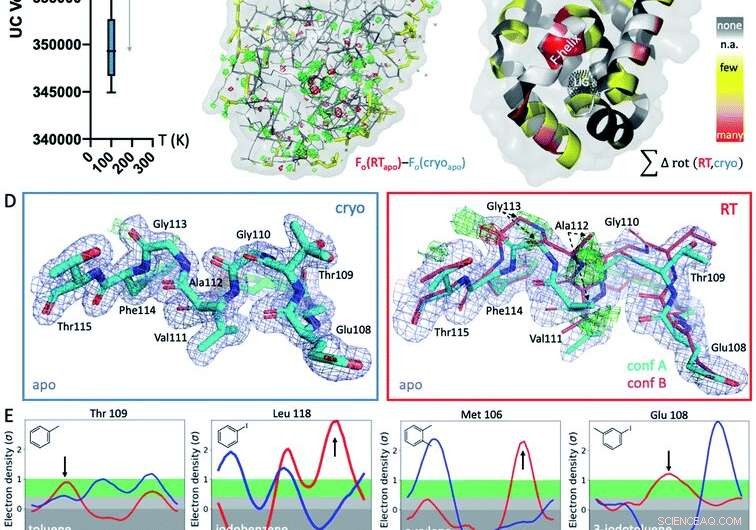
Fig. 1 Respuestas estructurales globales y locales a la temperatura. (A) Globalmente, Las estructuras a temperaturas criogénicas (crio; gráfico azul) son más variables y más compactas que sus equivalentes a temperatura ambiente (RT; gráfico rojo), como se muestra por los volúmenes promedio de celda unitaria (UC) en 9 estructuras emparejadas recolectadas a ambas temperaturas. (B) El mapa isomorfo Fo - Fo de la estructura apo recogida en crio versus RT muestra diferencias en la densidad de electrones (malla verde, densidad de electrones en diferencia positiva; malla roja, densidad de electrones de diferencia negativa) que indican efectos de temperatura idiosincrásicos, especialmente alrededor del sitio de unión al ligando en el lóbulo inferior, indicado por la malla punteada negra en el panel C (etiquetado LIG). (C) La aparición de diferencias de rotámero dependientes de la temperatura a través de las 9 estructuras se proyectan sobre los residuos respectivos en la estructura de apo de T4L; coloreado por la sensibilidad a la temperatura de cada residuo en los 9 pares de estructuras:amarillo para algunas estructuras, naranja para varias estructuras, y rojo para la mayoría de las estructuras que muestran diferencias de temperatura del residuo; las manchas blancas son Gly y Ala que no tienen ángulos Chi; y las manchas grises no muestran cambios en el rotámero con la temperatura. (D) Localmente, Los datos de RT de la cavidad de apo L99A revelan una conformación de hélice F alternativa (conf. B) en los mapas de densidad de electrones de diferencia de Fo - Fc (malla verde y roja para densidad positiva y negativa, respectivamente; solo la conformación cian A se incluyó en el refinamiento) que no es visible en crio; 2mFo - Mapa DFc mostrado como malla azul; el grosor del palo representa la ocupación relativa. (E) Los 8 complejos de ligandos muestran un cambio en la orientación preferida en respuesta a la temperatura en lugar de debido a la unión del ligando para al menos 1 residuo de rotámero en la hélice F cerca del sitio de unión del ligando. Gráficos de timbre para residuos seleccionados, con diferencias de rotámero en RT (rojo) versus crio (azul) indicadas por flechas. Crédito:DOI:10.1039 / D1SC02751D
Aproximadamente el 95% de todas las estructuras cristalinas obtenidas para diversas proteínas y depositadas en bases de datos públicas se capturan utilizando tecnología criogénica. Esta tecnología requiere condiciones de congelación. Los científicos del St. Jude Children's Research Hospital compararon las estructuras criogénicas con las observadas a temperatura ambiente. Los resultados, publicado hoy en Ciencia química , indican que la congelación puede introducir errores, hacen que se pierdan ciertas conformaciones (formas) y conduzcan a inexactitudes en los modelos computacionales.
Las estructuras de proteínas son esenciales para el proceso de desarrollo de fármacos porque proporcionan un mapa de cómo deben diseñarse los fármacos dirigidos.
"Necesitamos repensar cómo recolectamos, analizar y utilizar información estructural cuando nos proponemos descubrir moléculas bioactivas, "dijo el autor correspondiente Marcus Fischer, Doctor., Departamento de Biología Química y Terapéutica de St. Jude. "Puede ver la temperatura como un botón experimental que podemos utilizar para explorar las conformaciones de proteínas ocultas".
La temperatura marca la diferencia
Los investigadores han demostrado que la congelación distorsiona las conformaciones que adoptan las proteínas, a menudo introduciendo errores en las estructuras. El equipo también descubrió que algunas conformaciones que ocurren en condiciones de temperatura ambiente pueden pasarse por alto si solo se observan los resultados de las técnicas criogénicas.
Los investigadores realizaron una evaluación sistemática de estructuras criogénicas, comenzando con la cavidad de la lisozima T4 L99A. Esta proteína se considera un "caballo de batalla" en biología estructural para comprender la estabilidad de las proteínas, rigidez y termodinámica de unión a ligandos. El cambio a temperatura ambiente reveló nuevos cambios estructurales que se han pasado por alto durante décadas.
El equipo probó cuatro clases adicionales de proteínas. Los resultados se mantuvieron verdaderos independientemente del tipo de proteína que se evaluó.
"Cuando sales en invierno y tienes frío, te comprimes y encoges sobre ti mismo, y al sol cuando estás caliente te estiras. Las proteínas hacen lo mismo "Dijo Fischer.
Evitando errores
Los métodos computacionales son algoritmos que los investigadores utilizan para hacer predicciones o evaluar los datos obtenidos de sus experimentos. Los resultados indican que cuando estos métodos se basan en datos de estructuras criogénicas, Se pueden introducir errores que pueden afectar los resultados futuros.
Las técnicas criogénicas se han favorecido durante mucho tiempo porque facilitan la obtención de las estructuras. Conseguir estructuras a temperatura ambiente es más tedioso. Aunque hay formas de mitigar estos problemas, factores como la integridad de los datos y el daño por radiación son obstáculos adicionales para muchos investigadores a la hora de obtener estructuras a temperatura ambiente.
Si bien la detección de una forma de proteína oculta es informativa, aún faltaba mostrar el impacto de la nueva forma en los protocolos de descubrimiento de fármacos.
"Vimos que la proteína adoptó un estado para interactuar con los ligandos, y que la información faltante puede ayudar a mejorar la precisión del cribado virtual de fármacos y las simulaciones de interacción proteína-ligando, "dijo el co-primer autor Shanshan Bradford, Doctor., Departamento de Biología Química y Terapéutica de St. Jude.
Los investigadores subrayan que cuando solo se consideran las estructuras criogénicas, no hay forma de saber si hay errores, pero esa comparación con las estructuras de temperatura ambiente puede ayudar a aclarar la información y potencialmente revelar conocimientos adicionales que de otro modo se perderían.