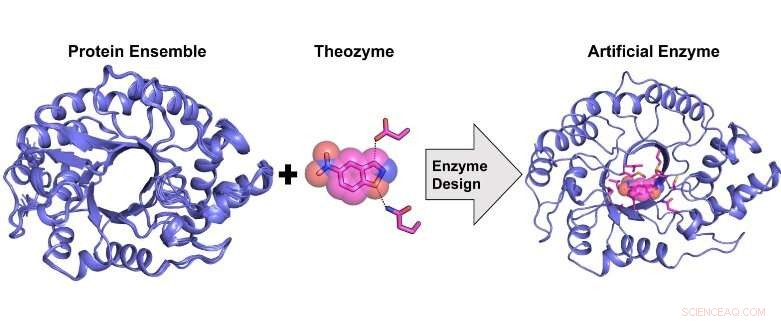
Diseño computacional de una enzima artificial altamente activa a partir de un conjunto estructural de proteínas. Crédito:Rojo Rakotoharisoa
Un grupo de investigadores de la Universidad de Ottawa ha estado buscando formas de mejorar las metodologías de diseño de enzimas y recientemente publicó sus hallazgos en Comunicaciones de la naturaleza .
Las enzimas se utilizan en muchas aplicaciones industriales y biotecnológicas. Con sus numerosas propiedades beneficiosas, son los catalizadores más eficientes que se conocen; incluso tienen el poder de acelerar las reacciones químicas en más de mil millones de veces. Pero dado que el número de actividades enzimáticas naturales es limitado, el número de aplicaciones también sigue siendo limitado. Si bien los investigadores han logrado crear enzimas artificiales, su eficiencia catalítica no alcanza el mismo nivel que el de las enzimas naturales.
Hablamos con el autor principal Roberto Chica, Catedrático del Departamento de Química y Ciencias Biomoleculares de la Universidad de Ottawa, para obtener más información sobre sus hallazgos.
¿Puede contarnos más sobre las enzimas diseñadas artificialmente?
"Durante los últimos 20 años, Los investigadores han diseñado con éxito enzimas artificiales desde cero para una variedad de transformaciones orgánicas modelo. Esto se hizo mediante un procedimiento llamado "diseño de enzima computacional" en el que un sitio catalítico se construyó computacionalmente sobre un andamio proteico preexistente desprovisto de la actividad catalítica objetivo.
Si bien tiene éxito, Este enfoque ha producido exclusivamente enzimas artificiales que muestran eficiencias catalíticas que son órdenes de magnitud más bajas que las de las enzimas naturales. requiriendo una optimización posterior usando lo que se llama 'evolución dirigida' para mejorar la actividad. La evolución dirigida es un proceso mediante el cual se introducen mutaciones aleatorias en una proteína para generar una gran biblioteca de enzimas mutantes. que luego se analizan para identificar mutaciones beneficiosas. A menudo requiere múltiples rondas de mutagénesis aleatoria y detección para aumentar la actividad de manera significativa ".
¿Cómo se relaciona su investigación con la evolución dirigida?
"En nuestro trabajo, revelamos cómo la evolución dirigida mejora la eficiencia catalítica de un biocatalizador diseñado computacionalmente en aproximadamente 1000 veces ajustando el conjunto de sub-estados estructurales que la enzima puede muestrear para favorecer a aquellos que son catalíticamente competentes.
Con base en estas observaciones, diseñamos un biocatalizador artificial con una eficiencia catalítica similar a la de la enzima natural promedio ".
¿Cuál es el descubrimiento impactante?
"Desarrollamos un procedimiento computacional novedoso para el diseño de enzimas que es más preciso que los métodos anteriores porque permite aproximar la flexibilidad intrínseca del andamio de proteínas utilizado como plantilla para el diseño".
¿Porque es esto importante?
"Esto es importante porque los métodos anteriores se centraban en crear una estructura estable que ignora el dinamismo inherente a las enzimas naturales, que es crucial para su función (es decir, las enzimas deben "moverse" para ser catalizadores eficientes).
Previamente, no se sabía si una enzima artificial que mostrara una eficiencia catalítica a la par con la de una enzima natural podría diseñarse computacionalmente. Mostramos que esto es posible, pero solo mediante el uso de un conjunto estructural de plantillas de proteínas que se aproximen a la flexibilidad conformacional en lugar de una única plantilla como se hizo anteriormente.
Los resultados presentados en nuestro manuscrito sugieren que el diseño de enzimas computacionales utilizando un conjunto estructural podría prevenir la necesidad de una evolución dirigida al permitir que se muestreen sub-estados catalíticamente competentes durante el procedimiento de diseño ".
¿Cuáles son las posibles aplicaciones de su investigación?
"Si pudiéramos diseñar, desde cero enzimas que pueden catalizar cualquier reacción química objetivo con alta eficiencia, abriría la puerta a biotecnologías de gran valor que actualmente son inaccesibles mediante el uso de enzimas naturales ".
¿Hay algo que le gustaría agregar?
Sí, la investigación se llevó a cabo de 2018 a 2020, en la Universidad de Ottawa y la Universidad de California, San Francisco.
El artículo "El diseño de enzimas basado en conjuntos puede recapitular los efectos de la evolución in silico dirigida por laboratorio" se publicó recientemente en Comunicaciones de la naturaleza .