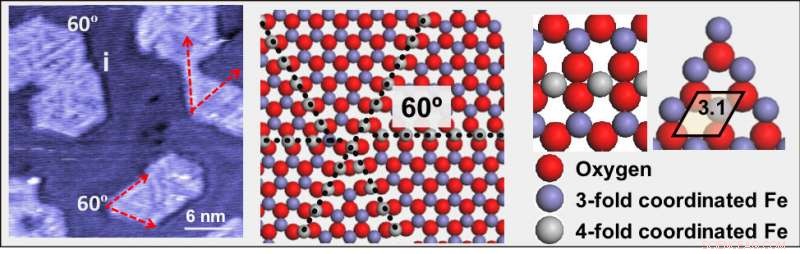
(Izquierda) Una imagen de microscopio de túnel de barrido a presión ambiental de óxido de hierro (FeO) sobre una superficie de oro. (Medio) Una ilustración que muestra líneas de dislocación hechas de átomos de hierro (gris), rodeado por cuatro átomos de oxígeno (rojo). (Derecha) Un modelo ampliado que muestra átomos de hierro coordinados por tres (púrpura) y cuatro (gris) átomos de oxígeno (rojo). Crédito:Laboratorio Nacional Brookhaven
Catalizadores, o sustancias que aceleran reacciones químicas, tienen varias aplicaciones industriales. Un catalizador ampliamente utilizado en convertidores catalíticos es el paladio, que ayuda a convertir el monóxido de carbono y los hidrocarburos tóxicos del escape de los vehículos en dióxido de carbono y agua a través de la oxidación. Pero al igual que otros metales preciosos como el platino, el paladio es raro. Debido a su oferta limitada, el paladio es un producto caro.
Reemplazar los catalizadores de metales preciosos por aquellos basados en metales más abundantes como el hierro disminuiría significativamente su costo. Sin embargo, catalizadores de hierro, si bien es muy eficiente, tienden a desactivarse rápidamente. Por ejemplo, Los catalizadores de óxido de hierro se "envenenan" cuando sus superficies están cubiertas por especies de carbono formadas durante las reacciones con moléculas que contienen carbono. como cuando el monóxido de carbono se disocia en carbono y oxígeno. El carbono depositado en la superficie del catalizador bloquea los sitios activos y evita que se produzcan más reacciones. así "envenenando" y finalmente desactivando el catalizador.
"Una forma de óxido de hierro, FeO, es un material muy económico que es activo para la oxidación, pero demasiado activo por su propio bien, "dijo Dario Stacchiola, líder del Grupo de Catálisis y Ciencia de Interfaces en el Centro de Nanomateriales Funcionales (CFN), una instalación para usuarios de la Oficina de Ciencias del Departamento de Energía de EE. UU. en el Laboratorio Nacional de Brookhaven, y profesor adjunto en el Departamento de Química de la Universidad de Stony Brook. "La creación de estructuras con hierro que sean lo suficientemente activas como para promover la reacción sin desactivarse podría abrir la puerta al uso de estos catalizadores en aplicaciones prácticas".
Stacchiola y sus colaboradores encontraron una estructura que podría hacer precisamente eso. Los científicos prepararon una fina capa de nanopartículas de FeO sobre una superficie de oro y descubrieron que las líneas de dislocación que aparecen en la superficie de FeO son muy activas pero no se envenenan. Estas líneas de defectos consisten en átomos de hierro rodeados por cuatro átomos de oxígeno en lugar de los tres normales.
El equipo detectó los defectos en imágenes de alta resolución registradas mediante microscopía de túnel de barrido (STM) a baja temperatura en la instalación de sondas proximales CFN y la Universidad de Ciencia y Tecnología de Nanjing en China. donde Tianchao Niu, miembro del equipo y ex postdoctorado de CFN, es ahora profesor. En STM, La corriente eléctrica se mide como un túnel de electrones entre la superficie de una muestra y una punta de metal que escanea la superficie.
Luego, los científicos estudiaron la oxidación y reducción de FeO en ambientes de gas oxígeno y monóxido de carbono, respectivamente. Para monitorear la estructura atómica y química del catalizador, realizaron estudios de ciencias de la superficie a temperatura ambiente y presión ambiental (AP). En particular, utilizaron un instrumento AP-STM de última generación disponible para usuarios académicos e industriales en el CFN.
"Queríamos ver si el catalizador estaría activo en condiciones moderadas porque las altas temperaturas o presiones pueden disociar el monóxido de carbono en carbono, desactivando el catalizador, ", dijo Stacchiola." Al realizar estos estudios a presión ambiental, podemos observar cómo cambia el material mientras está trabajando. Sólo entonces podremos comprender los procesos químicos que ocurren a nivel atómico y molecular ".
Tras la oxidación, las líneas de dislocación desaparecieron y la altura de la capa de FeO aumentó, sugiriendo que se habían incorporado átomos de oxígeno. Una exposición secuencial al monóxido de carbono resultó en la regeneración de las líneas de dislocación y una reducción en la altura de FeO, que indica la eliminación de los átomos de oxígeno. Después de obtener imágenes de cada uno de estos pasos de reacción a través de AP-STM, Los científicos utilizaron espectroscopía de fotoelectrones de rayos X (XPS) para determinar qué especies químicas estaban presentes y sus respectivos estados de oxidación (número de electrones extraídos o añadidos). Esta información química se puede determinar en función de la energía de los electrones emitidos desde la superficie de la muestra después de la excitación por rayos X.
"La oxidación y reducción de FeO es reversible, "dijo Stacchiola." Se agregó y eliminó oxígeno sin dejar carbón. Debido a que el hierro en las líneas de dislocación está coordinado con un número de átomos de oxígeno diferente al habitual, su estado de oxidación cambia. Este cambio favorece la disociación del oxígeno molecular, una molécula muy estable, en dos átomos de oxígeno. La acumulación de oxígeno atómico en la superficie de FeO, a su vez, promueve la oxidación del monóxido de carbono ".
Zhao Jiang de la Universidad Xi'an Jiaotong en China luego calculó la vía de reacción energética. Jiang descubrió que la oxidación del monóxido de carbono es energéticamente más fácil cuando se adsorben átomos de oxígeno adicionales en la superficie de FeO.
Avanzando, Stacchiola y su grupo continuarán explorando metales abundantes en la tierra para la catálisis. Ashley Head, un científico en el grupo, en colaboración con Baran Eren del Instituto de Ciencias Weizmann en Israel, investigó recientemente el papel que juegan las impurezas superficiales y el óxido de manganeso en la mejora catalítica de los catalizadores de cobalto para la conversión de monóxido de carbono e hidrógeno en gas de síntesis, que se utiliza en la fabricación de productos químicos y combustibles. Este experimento fue uno de los primeros realizados completamente con el instrumento AP-XPS en la instalación de sondas proximales CFN.
"Las instalaciones complementarias de microscopía y espectroscopía in situ abiertas a los usuarios de CFN son ideales para este tipo de estudios de química de superficies, "dijo Stacchiola.