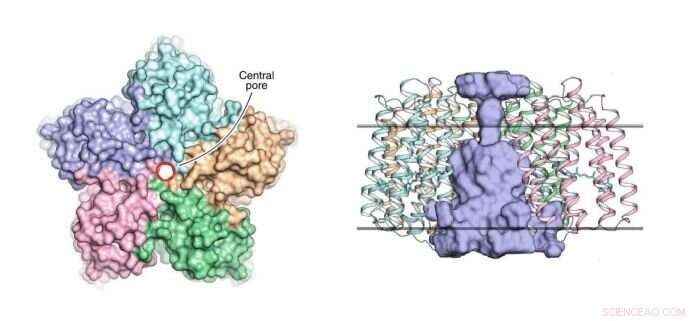
Izquierda:vista del pentámero OLPVRII desde el lado citoplásmico. El poro central está contorneado por un círculo rojo. Derecha:vista lateral del pentámero. El poro central es de color azul claro. Los límites del núcleo de la membrana hidrófoba / hidrófila se muestran como líneas horizontales continuas. Crédito:Dmitry Bratanov et al./Nature Communications
La estructura de una rodopsina II orgánica del lago Phycodnavirus (OLPVRII), que es una proteína única que se encuentra en el genoma de virus gigantes, se ha determinado gracias al trabajo de los graduados del MIPT y Ph.D. estudiantes. El artículo fue publicado en Comunicaciones de la naturaleza .
El estudio es el resultado de una colaboración que incluyó a muchos ex alumnos del MIPT. Dmitry Bratanov estaba entre ellos. Dmitry, quien actualmente trabaja en el Instituto de Sistemas Complejos (ICS-6) en el Centro de Investigación Juelich, Alemania, dice que aunque las rodopsinas virales se descubrieron por primera vez en los llamados virus gigantes hace varios años, su estructura, función, y el papel biológico no han sido claros hasta ahora.
Un virus gigante es un virus muy grande, el tamaño de una bacteria típica. Es tan grande que es visible con un microscopio óptico. Los virus gigantes infectan las algas verdes, que producen oxígeno y ayudan a mantener el equilibrio ecológico natural de los océanos del mundo. Por lo tanto, Los virus gigantes son de considerable interés para la investigación desde una perspectiva medioambiental.
"En este trabajo, desciframos la estructura de alta resolución de OLPVRII, Caracterizado funcionalmente la proteína, y demostró que forma pentámeros no solo en cristales sino también en membranas lipídicas, "explica Dmitry." No fue una tarea fácil. Se tuvieron que realizar numerosos experimentos, para algunos de ellos utilizamos técnicas y equipos sofisticados. Lo que hemos logrado es el resultado del arduo y meticuloso trabajo del grupo internacional de científicos ".
Esta organización pentamérica se ha observado previamente en algunas otras rodopsinas, tal como, por ejemplo, en la bomba de sodio impulsada por luz KR2. Sin embargo, lo que hace que la estructura OLPVRII sea peculiar es que tiene un poro inusual en el centro (ver figura 1). Su función permanece desconocida.
"Creemos que quizás el poro actúa como un canal de iones, muy probablemente para iones de cloruro, "dice Kirill Kovalev, coautor del artículo y Ph.D. estudiante en MIPT.
Los canales de iones son proteínas que crean una vía pasiva para que los iones fluyan a través de la membrana celular. Estos canales suelen estar cerrados en la oscuridad, lo que significa que los iones no pueden entrar ni salir de la célula. En el caso de canales sensibles a la luz, se abren en respuesta a la absorción de luz, lo que permite que los iones fluyan por el gradiente de concentración. En otras palabras, Los iones se mueven en la dirección que igualaría las concentraciones de iones dentro y fuera de la célula.
Un ejemplo típico de canal sensible a la luz es la canalrodopsina 2. Se encontró en el alga verde Chlamydomonas reinhardtii y se usa ampliamente como herramienta optogenética. En cuanto a OLPVRII, los investigadores piensan que este podría ser el primer canal iónico pentamérico activado por luz jamás descubierto, como sugiere la estructura determinada y las simulaciones moleculares.
"Sin embargo, la actividad del canal de OLPVRII aún no se ha demostrado, "señala Kirill Kovalev". Continuaremos nuestra investigación y definitivamente descubriremos por qué esta inusual rodopsina fue creada por la naturaleza. Quizás ayude al huésped a continuar desempeñando sus funciones de soporte vital cuando una célula está infectada por un virus, o tal vez sea un sensor ".
Dicho eso el estudio de la estructura de la rodopsina viral arrojó algo de luz sobre cómo funciona. Se demostró que OLPVRII, como la mayoría de las otras rodopsinas, actúa como una bomba de protones. Sin embargo, es poco probable que esta sea su función principal, dicen los investigadores. Su propósito principal aún no se ha investigado ni probado.
"Si demostramos que esta rodopsina viral es de hecho un canal iónico, puede convertirse en una gran herramienta en optogenética y aplicaciones biomédicas, "dice el coautor del artículo Valentin Gordeliy, quien dirige grupos de investigación en el Instituto de Biología Estructural de Grenoble y el Centro de Investigación Juelich. Valentin también es coordinador de investigación en el Centro de Investigación de Mecanismos Moleculares del Envejecimiento y Enfermedades Relacionadas con la Edad del MIPT.
Los investigadores dicen que la nueva herramienta superará a todas sus contrapartes gracias a las ventajas de su estructura pentamérica:la facilidad con la que se pueden manipular genéticamente las propiedades de la proteína y quizás las altas corrientes que circulan por el poro central.
Tener el derecho prioritario de utilizar su invención, los autores del artículo han presentado una solicitud de patente para el uso de la rodopsina viral OLPVRII en el campo de la optogenética.
La optogenética es una rama de la biofísica que utiliza la luz para controlar las células de un organismo vivo. Como ya se ha demostrado, la optogenética se puede aplicar para restaurar la pérdida de visión y audición, ayudar a controlar el movimiento en pacientes neurológicos, y tratar a las personas con enfermedad de Parkinson y Alzheimer.
Según Valentin Gordeliy, MIPT cuenta con todo el equipamiento necesario para realizar un estudio detallado de las funciones de la rodopsina viral. El grupo continuará su investigación sobre OLPVRII, que será de gran importancia para la biología, ciencia evolutiva, optogenética, y ecología.