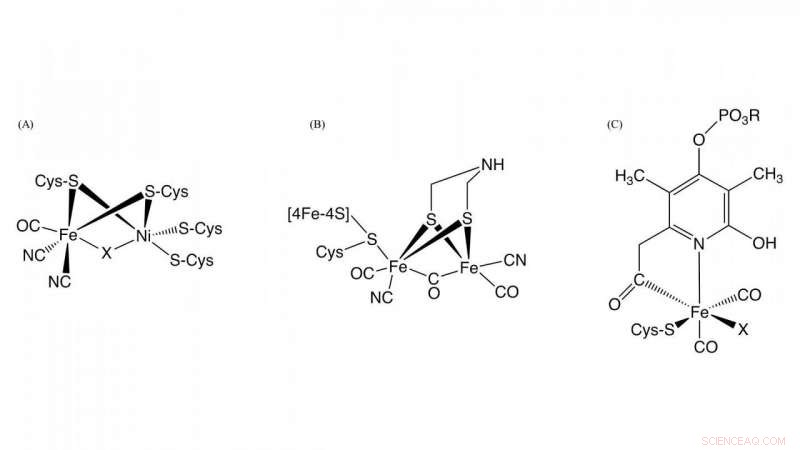
Figura 1. Estructura de los sitios activos en [NiFe] -hidrogenasa, [FeFe] -hidrogenasa, y [Fe] -hidrogenasa Crédito:NINS / IMS
Un grupo de investigación que incluye investigadores del Centro de Investigación Exploratoria sobre Vida y Sistemas Vivientes (ExCELLS), Instituto de Ciencia Molecular (IMS) en los Institutos Nacionales de Ciencias Naturales, y la Universidad de Osaka han revelado el mecanismo detallado de la biosíntesis de monóxido de carbono esencial para la maduración del sitio activo de NiFe-hidrogenasa.
Hidrogenasa, que es una metaloenzima responsable de la oxidación del gas hidrógeno y la reducción de protones, juega un papel clave en el metabolismo bacteriano del hidrógeno. Basado en las diferencias de contenido de metal en el sitio activo, se clasifican en tres grupos:NiFe-, FeFe-, y Fe-hidrogenasas que contienen diferentes complejos metálicos como centros activos en estas enzimas (Figura 1). Aunque las estructuras en los centros activos de ellos son diferentes, Es esencial para la actividad de la hidrogenasa que el monóxido de carbono (CO) esté coordinado con el ión de hierro en el centro activo. Se sabe que el CO se biosintetiza mediante una reacción enzimática, pero se desconocía el detalle de la biosíntesis de CO.
En esta investigación, el grupo determinó la estructura cristalina de la enzima (HypX) responsable de la biosíntesis del CO (Figura 2), basado en el cual HypX biosintetiza CO mediante una reacción sin precedentes para la maduración de NiFe-hidrogenasa. HypX consta de dos dominios:los dominios N-terminal y C-terminal. Una cavidad continua que conecta los dominios N- y C-terminales está presente en el interior de HypX (Figura 2). En la estructura cristalina, la coenzima A (CoA) está unida a la región C-terminal de la cavidad.
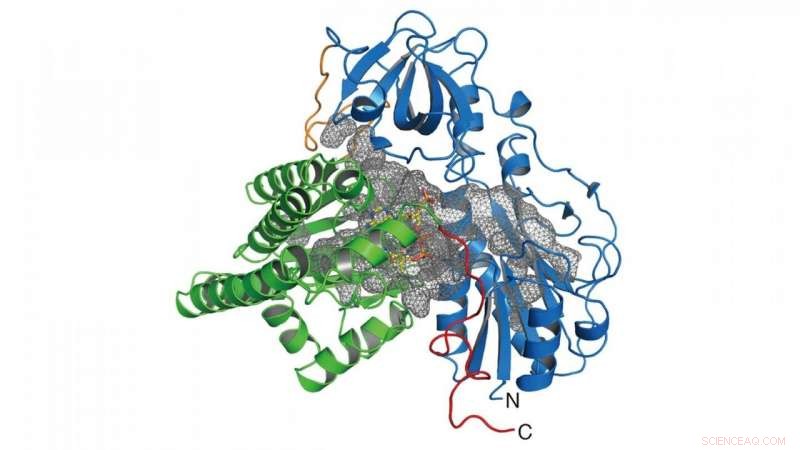
Figura 2. Estructura cristalina de HypX. Los dominios N- y C-terminales se muestran en azul y verde, respectivamente. La cavidad interior de HypX se muestra en una malla gris. Crédito:NINS / IMS
Se producen dos reacciones diferentes en los dominios N- y C-terminales. En el dominio N-terminal, una reacción de transferencia de grupos formilo a partir de formiltetrahidrofolato, que está unido en la región N-terminal de la cavidad como sustrato a CoA, tiene lugar (paso de reacción 1 en la Fig. 3). En este momento, CoA en la cavidad adopta la conformación extendida lineal, y el grupo SH de CoA está ubicado cerca del grupo formilo en el formiltetrahidrofolato unido en el dominio N-terminal. Luego, formil-CoA se produce como un intermedio de reacción mediante la reacción de transferencia de grupos formilo de formiltetrahidrofolato a CoA.
En el siguiente paso, formil-CoA sufre un gran cambio conformacional en la cavidad de modo que el grupo formilo en la posición terminal de formil-CoA se localiza en el sitio activo en el dominio C-terminal de HypX (paso de reacción 2 en la Fig. 3). En el dominio C-terminal, El CO se forma por descarbonilación de formil-CoA (paso de reacción 3 en la Fig. 3).
Esta reacción de biosíntesis de CO es una reacción novedosa y sin precedentes. CoA es bien conocida como coenzima, que tiene un papel importante en el metabolismo de los ácidos grasos y el metabolismo energético celular a través del ciclo del ácido cítrico. Sin embargo, nunca se ha informado que CoA / formil-CoA esté involucrado en reacciones de biosíntesis de CO. Esta investigación ha revelado una función fisiológica novedosa de una coenzima CoA conocida.
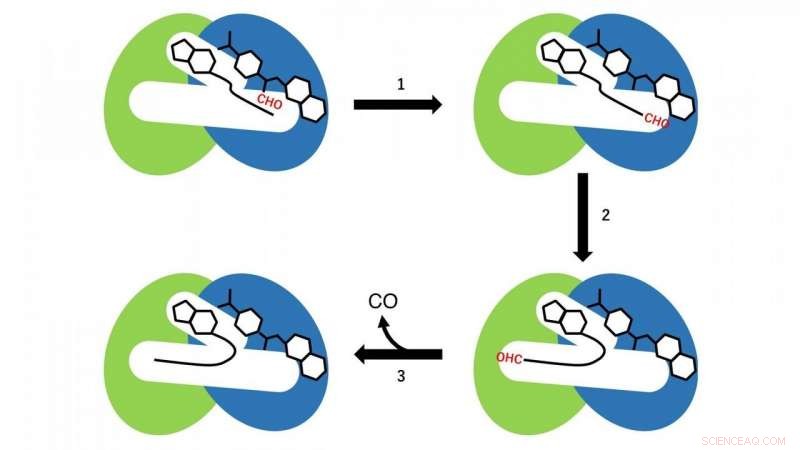
Figura 3. Esquema de reacción de la biosíntesis de CO por HypX. Los dominios N- y C-terminales se muestran en azul y verde respectivamente. El grupo formilo (CHO) se muestra en rojo. Crédito:NINS / IMS
Perspectivas de futuro:
Los mecanismos biosintéticos de las metaloenzimas siguen siendo desconocidos en muchos casos. Queda por dilucidar especialmente cómo se han ensamblado los centros activos de metaloenzimas que contienen metales. En este trabajo, determinamos la primera estructura cristalina de la enzima que cataliza la reacción biosintética del monóxido de carbono esencial para la construcción del sitio activo de [NiFe] hidrogenasa. En el futuro, Continuaremos la investigación para dilucidar el mecanismo detallado de toda la vía de maduración de la hidrogenasa en base a este resultado.