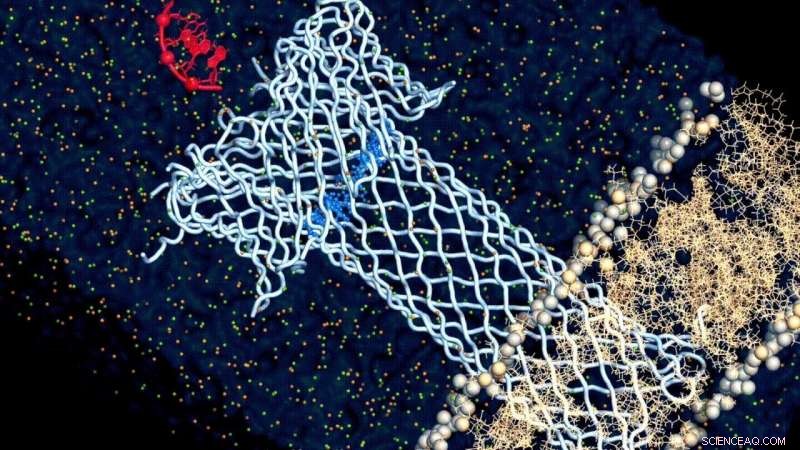
Crédito:Chan Cao, EPFL
Algunos tipos de bacterias tienen la capacidad de perforar otras células y matarlas. Lo hacen liberando proteínas especializadas llamadas "toxinas formadoras de poros" (PFT) que se adhieren a la membrana de la célula y forman un canal en forma de tubo que la atraviesa. Esta estructura a través de la membrana se llama poro. Perforado por múltiples PFT, la célula objetivo se autodestruye.
Sin embargo, Las PFT han despertado mucho interés más allá de las infecciones bacterianas. Los poros de tamaño nanométrico que forman se utilizan para detectar biomoléculas:una molécula biológica, p.ej., ADN o ARN, pasa a través del nanoporo como una cuerda dirigida por un voltaje, y sus componentes individuales (por ejemplo, ácidos nucleicos en el ADN) emiten señales eléctricas distintas que se pueden leer. De hecho, La detección de nanoporos ya está en el mercado como una herramienta importante para la secuenciación de ADN o ARN.
Publicando en Comunicaciones de la naturaleza , Los científicos dirigidos por Matteo Dal Peraro en EPFL han estudiado otra PFT importante que se puede usar de manera efectiva para una detección más compleja, como la secuenciación de proteínas. La toxina es aerolisina, que es producida por la bacteria Aeromonas hydrophila, y es el "miembro fundador" de una gran familia de PFT que se encuentran en muchos organismos.
Una de las principales ventajas de la aerolisina es que forma poros muy estrechos que pueden distinguir moléculas con una resolución mucho más alta que otras toxinas. Estudios anteriores han demostrado que la aerolisina se puede utilizar para "detectar" varias biomoléculas, pero se han realizado pocos estudios sobre la relación entre la estructura de la aerolisina y sus capacidades de detección molecular.
Los investigadores utilizaron primero un modelo estructural de aerolisina para estudiar su estructura con simulaciones por computadora. Como proteína la aerolisina está formada por aminoácidos, y el modelo ayudó a los científicos a comprender cómo esos aminoácidos afectan la función de la aerolisina en general.
Una vez que comprendieron esa relación, los investigadores cambiaron estratégicamente los aminoácidos en el modelo informático. Luego, el modelo predijo el posible impacto de cada cambio en la función general de la aerolisina.
Al final del proceso computacional, Dr. Chan Cao, el autor principal de este trabajo, produjo 16 transgénicos, poros de aerolisina "mutante", los incrustó en bicapas lipídicas para simular su posición en una membrana celular, y llevó a cabo varias mediciones (registro de un solo canal y experimentos de translocación molecular) para comprender cómo la conductancia iónica, selectividad iónica, y las propiedades de translocación del poro de aerolisina están reguladas a nivel molecular.
Y con este enfoque, los investigadores finalmente encontraron lo que impulsa la relación entre la estructura y la función de la aerolisina:su tapa. El poro de aerolisina no es solo un tubo que atraviesa la membrana, pero también tiene una estructura en forma de tapa que atrae y amarra la molécula objetivo y la "tira" a través del canal del poro. Y el estudio encontró que es la electrostática en esta región de la tapa la que dicta esta relación.
"Al comprender los detalles de cómo la estructura del poro de aerolisina se conecta con su función, ahora podemos diseñar poros personalizados para diversas aplicaciones de detección, ", dice Dal Peraro." Estos abrirían nuevos, oportunidades inexploradas para secuenciar biomoléculas como ADN, proteínas y sus modificaciones postraduccionales con aplicaciones prometedoras en la secuenciación de genes y la detección de biomarcadores para el diagnóstico ". Los científicos ya han presentado una patente para su secuenciación y caracterización de los poros de aerolisina modificados genéticamente.