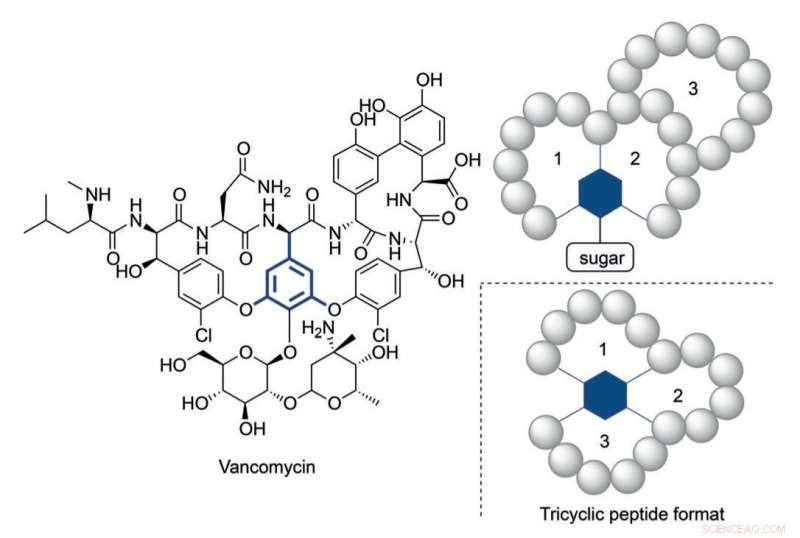
Estructura de vancomicina y un formato de péptido tricíclico inspirado en su estructura multicíclica. Crédito:HIMS
Los químicos del Instituto Van 't Hoff de Ciencias Moleculares (HIMS) de la Universidad de Ámsterdam y Pepscan (Lelystad) han desarrollado una nueva metodología para bloquear péptidos lineales en estructuras tricíclicas altamente rigidizadas con potencial farmacéutico. Sus hallazgos acaban de ser reportados en Angewandte Chemie .
La metodología, desarrollado por HIMS Ph.D. estudiante Gaston Richelle, permite la síntesis paralela de múltiples péptidos tricíclicos en un formato de biblioteca. Esto permite un cribado biológico posterior para identificar nuevos péptidos terapéuticos.
Mayor nivel de complejidad estructural
Durante la última década, los péptidos cíclicos han surgido como una clase prometedora de terapias, mostrando una amplia ventana terapéutica que va desde aplicaciones antifertilidad hasta aplicaciones antivirales y anticancerígenas. Se han identificado muchos péptidos monocíclicos y bicíclicos y el número de péptidos cíclicos que ingresan a los ensayos clínicos ha aumentado drásticamente.
Aún así, ha quedado claro que en algunos casos se necesitan péptidos estructuralmente más complejos para alcanzar niveles de actividad apropiados. Vancomicina el péptido antibiótico tricíclico de 'último recurso', proporciona un ejemplo ilustrativo de una construcción tan compleja. La resistencia alarmantemente creciente de las bacterias contra los antibióticos disponibles en la actualidad requiere construcciones de péptidos complejos en analogía con la vancomicina.
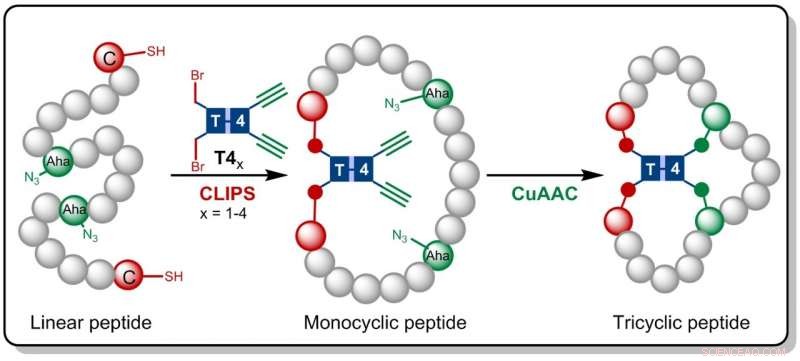
Crédito:HIMS
La búsqueda de nuevas rutas sintéticas para complejos péptidos multicíclicos ha ganado, por tanto, un gran interés. Las metodologías reportadas anteriormente para crear péptidos multicíclicos se han limitado debido a la formación de múltiples isómeros, protocolos de reacción laboriosos o diversidad estructural limitada.
CLIPS combinados con CuAAC
En la investigación ahora publicada en Angewandte Chemie , los químicos de Amsterdam se basan en la tecnología CLIPS desarrollada anteriormente en Pepscan. Este método para el 'Enlace químico de péptidos en armazones' produce péptidos monocíclicos y bicíclicos que han demostrado exhibir selectividades y afinidades mejoradas contra las proteínas diana.
Gaston Richelle ahora ha combinado el método CLIPS con la química de 'clic' CuAAC totalmente compatible, que conduce a la formación de péptidos tricíclicos complejos. Haciendo uso de moléculas de andamio flexibles, los péptidos tricíclicos buscados se forman de una manera isoméricamente pura. La principal ventaja de la nueva metodología es que las reacciones CLIPS y CuAAC se pueden llevar a cabo en un procedimiento de un solo recipiente sin limitaciones a la naturaleza y cantidad de aminoácidos que se implementan en los bucles peptídicos.
Como resultado, la metodología se puede aplicar en bibliotecas de péptidos de alta diversidad para generar una amplia gama de topologías tricíclicas que pueden seleccionarse para detectar actividad biológica. Actualmente se llevan a cabo múltiples cribados de inhibición, p.ej. contra enzimas que son muy abundantes en las células cancerosas en la primera etapa. También se llevan a cabo nuevos estudios de actividad antimicrobiana contra MRSA y Staphylococcus aureus. Agregando a esto, El equipo de investigación está estudiando actualmente el uso de andamios de T6 aún más complejos para crear péptidos penta y hexacíclicos.