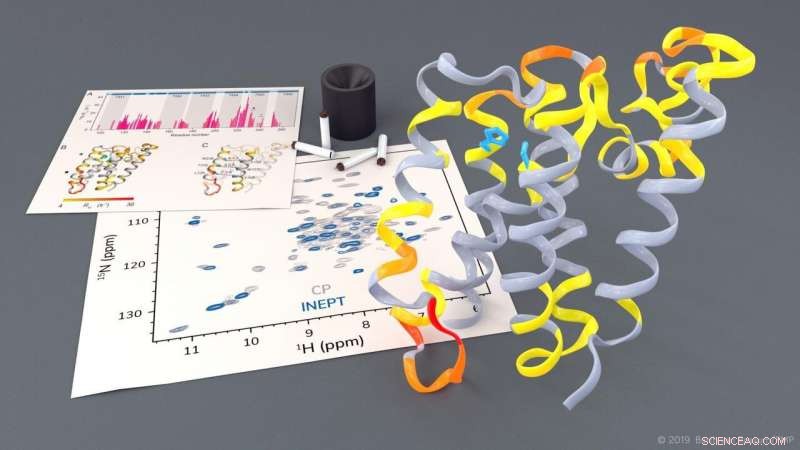
Investigación de la proteasa romboide GlpG por RMN de estado sólido. Crédito:Barth van Rossum, FMP
Las proteasas romboides son proteínas de membrana clínicamente relevantes que desempeñan un papel clave en diversas enfermedades. Usando espectroscopia de RMN de estado sólido, investigadores de Leibniz-Forschungsinstitut für Molekulare Pharmakologie (FMP) de Berlín ahora han podido observar cómo funcionan las proteasas romboides en un entorno lipídico nativo. Las imágenes dinámicas obtenidas serán útiles para el desarrollo de nuevos medicamentos para enfermedades como el Parkinson y la malaria. Los resultados de este trabajo pionero acaban de publicarse en la Revista de la Sociedad Química Estadounidense .
Decenas de miles de proteínas actúan en nuestras células, alrededor del reloj. Algunos de estos trabajadores trabajadores se sientan en la membrana celular, entre ellos la familia de las proteasas romboides. Dado que estas proteasas intramembrana están involucradas en muchos procesos biológicos, y también juegan un papel clave en enfermedades como el Parkinson, diabetes, cáncer y malaria, son de gran relevancia clínica.
Previamente, había sido posible ver proteasas romboides usando cristalografía de rayos X. Sin embargo, este método solo pudo proporcionar imágenes estáticas de proteínas en un entorno artificial. Por lo tanto, siguió siendo de gran interés ver qué sucede en la membrana celular donde las proteínas realizan su tarea principal, que escinde otras proteínas de membrana, desencadenando una cascada de señalización.
La puerta que se sospecha desde hace mucho tiempo que se abre, de hecho existe
El grupo de investigación dirigido por el profesor Adam Lange del Leibniz-Forschungsinstitut für Molekulare Pharmakologie (FMP) ha podido investigar este proceso tan complejo. por primera vez utilizando espectroscopía de RMN de estado sólido en un entorno similar al nativo. Los investigadores pudieron observar cómo se mueven ciertas partes de la proteasa. También notaron que, para escindir otras proteínas, una puerta se abre brevemente para permitir que estas proteínas sustrato entren en el centro activo de la proteasa.
Hallazgos relevantes para la interferencia farmacológica
El proyecto, llevada a cabo dentro del Clúster de Excelencia UniSysCat, sienta las bases para una caracterización aún mejor de las proteasas romboides. Es más:el conocimiento adquirido será útil para que los investigadores investiguen cómo pueden influir farmacológicamente en las proteínas de membrana clínicamente relevantes. También Lange y su equipo ahora quieren buscar sustancias para inhibir las proteasas romboides errantes.