
Representación artística de una membrana con proteínas incrustadas:los investigadores de ETH Zurich han desarrollado un método que impulsará la elucidación estructural de tales moléculas. Crédito:www.colourbox.com
Los investigadores de ETH han desarrollado un nuevo método para cristalizar proteínas de membrana grandes para determinar su estructura. Esto beneficiará a la investigación biológica y la industria farmacéutica.
Las proteínas integradas en la membrana son una parte esencial de las células y de cualquier forma de vida. No solo existen en muchas variedades diferentes, pero también realizan una amplia gama de funciones, que van desde la comunicación intracelular y el transporte de sustancias dentro o fuera de la célula hasta la mediación de la respuesta inmune. Las proteínas de membrana se consideran importantes estructuras diana terapéuticas y de diagnóstico. Si se conocen su estructura y funciones, Los investigadores farmacéuticos pueden desarrollar sustancias activas que influyan en estas funciones de manera específica.
Hasta ahora, sin embargo, Elucidar la estructura de las proteínas de membrana ha sido muy difícil ya que primero requiere que los investigadores aíslen un gran número de estas moléculas y formen cristales a partir de ellas. Ahí radica la dificultad:las proteínas de membrana son insolubles en agua y, a menudo, demasiado grandes y heterogéneas para cristalizarlas utilizando los métodos estándar.
Ahora, el grupo liderado por Raffaele Mezzenga, Profesor de Alimentos y Materiales Blandos en ETH Zurich, está trabajando para eliminar esta restricción. En una publicación de la revista Comunicaciones de la naturaleza , el grupo presenta un método general, que se puede utilizar para cristalizar proteínas de membrana de cualquier tipo o tamaño.
Mezcla de lípidos y agua como cámara de reacción
La base del nuevo método se estableció en la década de 1990 con el método denominado "en meso cristalización":las proteínas se aíslan y concentran utilizando mezclas estables de agua y lípidos conocidas como mesofases lipídicas. En mesofases de este tipo, un proceso de autoensamblaje conduce a una red tridimensional de canales de agua doblados cuyas paredes están formadas por lípidos, como en una biomembrana. Estos canales de agua suelen tener un diámetro de 3-4 nanómetros, y el motivo cúbico básico de la red se repite a intervalos regulares.
En canales de este tipo, las proteínas de la membrana se incrustan en las paredes utilizando la parte hidrófoba que, de otro modo, se asienta en la membrana celular. El resto de la proteína termina en el interior del canal de agua, y las proteínas, una vez reconstituido correctamente, entonces puede comenzar a cristalizar. Es precisamente porque los canales ofrecen tan poco espacio que en el pasado, solo se pudieron cristalizar pequeñas proteínas de membrana; las proteínas grandes se trituraron y no formaron cristales.
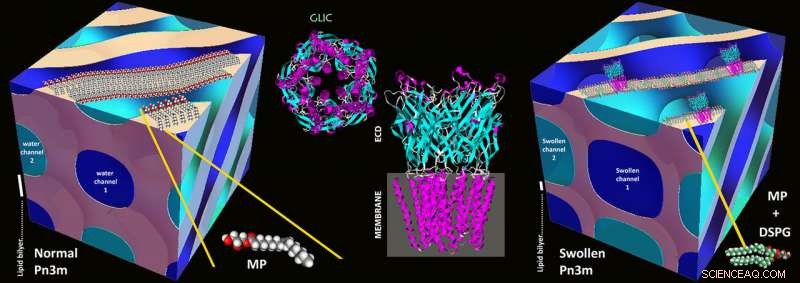
Ilustraciones esquemáticas de una mesofase cúbica normal de Pn3m compuesta de MP:agua (izquierda), Estructura de la proteína GLIC (centro), y en la meso cristalización de la proteína GLIC en una mesofase cúbica de Pn3m muy hinchada compuesta de DSPG:MP:agua (derecha). Crédito:Zabara A et al, Nat.Comm., 2018
Canales expandidos usando lípidos cargados
Los investigadores de ETH ahora han utilizado un truco para expandir los canales:mezclaron una pequeña proporción de lípidos cargados eléctricamente con los lípidos. Estos se repelen entre sí y así inflan los canales, aumentando su diámetro a 20 nanómetros. Aunque los primeros intentos de hinchar electrostáticamente los canales de agua en las mesofases lipídicas se remontan a principios de la década de 2000 y han continuado de manera constante hasta hace poco, esta es la primera evolución demostrada de esta estrategia hacia una metodología de importancia general.
Gracias a estas mesofases lipídicas hinchadas, Por supuesto, Mezzenga y sus colegas lograron cristalizar grandes proteínas de membrana y luego dilucidar su estructura.
Los investigadores de ETH practicaron en la proteína de membrana llamada GLIC (canal iónico controlado por ligando de Gloeobacter), que proviene de bacterias. GLIC tiene varias subunidades grandes que se encuentran fuera de la membrana bacteriana en la parte exterior de la célula. En el pasado, Se utilizó un método diferente para cristalizar este complejo ya que estos dominios eran demasiado grandes. "Nuestro procedimiento no solo mejoró la cristalización, pero también produjo cristales extremadamente compactos pertenecientes a un nuevo grupo cristalográfico para esta proteína, "dice Mezzenga. Además, los investigadores pudieron cristalizar esta proteína de canal en su configuración cerrada por primera vez. Hasta ahora, los investigadores pudieron cristalizar el complejo solo en su estado abierto utilizando un método diferente.
Impulso esperado para elucidación estructural
Es probable que el nuevo método "generalizado en meso" sea de gran interés para los biólogos estructurales en particular, que hasta ahora han luchado por dilucidar la estructura de las proteínas de membrana grandes. "Esta herramienta dará un nuevo impulso a la elucidación estructural, ya que abre proteínas que antes estaban fuera de su alcance, "dice Mezzenga.
En el presente, los científicos conocen la estructura exacta de solo 360 pequeñas proteínas de membrana, o aproximadamente una séptima parte de todas las proteínas de membrana. Se desconoce la estructura de las muchas proteínas de membrana restantes.
Según Mezzenga, la investigación también puede beneficiar a la industria farmacéutica. "La capacidad de determinar la estructura es de suma importancia para el desarrollo de nuevos fármacos, ", dice." Este método lo hará considerablemente más fácil y proporcionará un nuevo impulso en el campo ".