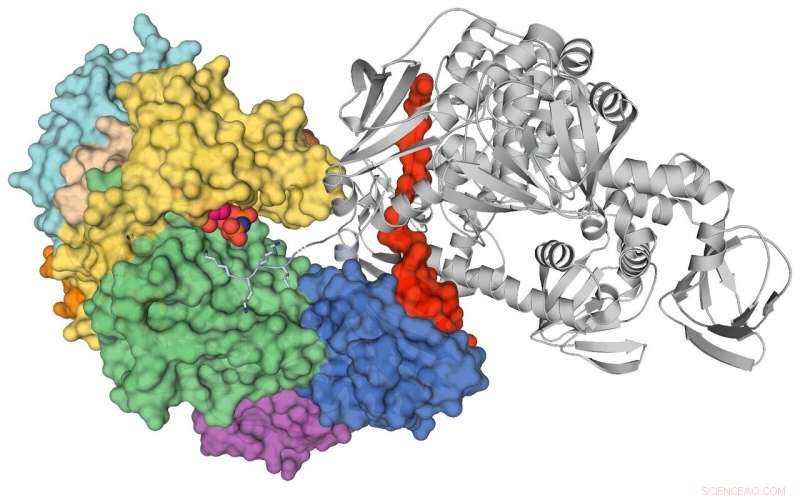
Cristal PKG. Crédito:Fuente de luz canadiense
La malaria es endémica en grandes áreas de África, Asia y América del Sur y anualmente mata a más de 400, 000 personas, la mayoría de los cuales son niños menores de 5 años, con cientos de millones de nuevas infecciones cada año.
Aunque se dispone de combinaciones de medicamentos a base de artemisinina para tratar la malaria, los informes del sudeste asiático de fracasos en el tratamiento están generando preocupación sobre la propagación de la resistencia a los medicamentos a África. Afortunadamente, Hay esperanzas en el horizonte porque hay varios candidatos a fármacos antipalúdicos nuevos que se someten a pruebas clínicas, así como otros objetivos farmacológicos prometedores que están bajo investigación.
Un equipo de investigación internacional ha determinado por primera vez la estructura atómica de una proteína quinasa llamada PKG en los parásitos Plasmodium que causan la malaria, un hallazgo que potencialmente ayudará a crear una nueva generación de medicamentos contra la malaria y avanzará en la investigación fundamental.
PKG juega un papel esencial en las etapas de desarrollo del complejo ciclo de vida del parásito, por lo que comprender su estructura es clave para desarrollar terapias contra la malaria que se dirijan específicamente a la PKG y no a otras enzimas humanas, según el investigador Dr. Charles Calmettes.
"Hasta ahora, no teníamos la estructura para PKG de ningún organismo. Existen diferencias entre la PKG humana y la PKG de la malaria, pero hasta ahora este es el mejor modelo que tenemos para entender la versión de la proteína en mamíferos, "dijo Calmettes, profesor asistente en INRS-Institut Armand-Frappier en Quebec.
Se han fabricado potentes inhibidores de PKG de primera generación que se dirigen selectivamente al parásito PKG, pero no la PKG humana debido a una diferencia estructural significativa entre las dos enzimas en la bolsa de unión al inhibidor revelada por estudios de cristalografía.
La línea de luz CMCF de Canadian Light Source en la Universidad de Saskatchewan permitió a los investigadores optimizar los cristales PKG y recopilar conjuntos de datos iniciales para el proyecto.
"Tener acceso al potente haz de rayos X para recopilar datos de difracción y cribar cristales de proteínas en el CLS fue muy importante para completar nuestro proyecto, " él dijo, La adición de gran parte de la elucidación de la estructura de la proteína fue realizada por investigadores del Consorcio de Genómica Estructural de la Universidad de Toronto.
Cuando un mosquito infectado pica a un humano, Los parásitos de la malaria se llevan rápidamente al hígado. donde invaden las células del hígado (hepatocitos) y se multiplican. Los hepatocitos estallan, liberando decenas de miles de parásitos transformados (merozoitos) que invaden los glóbulos rojos. Allí, los merozoitos se multiplican aún más y rompen las células sanguíneas, un proceso que produce fiebre, escalofríos, náuseas y otros efectos desagradables de la malaria.
Un mosquito que se alimenta de la sangre de un ser humano infectado recogerá el parásito y transmitirá la enfermedad a otros humanos. que continúa el ciclo mortal.
Experimentos anteriores han demostrado que varias etapas de desarrollo del parásito dependen de PKG, que controla la señalización del calcio dentro de las células. Las señales de calcio regulan las actividades celulares, incluido el momento preciso de la liberación de los merozoitos de las células sanguíneas, y los procesos de replicación de los parásitos dentro del mosquito.
"El PKG es un buen objetivo farmacológico porque puede dirigirse a las etapas del ciclo de vida del parásito que causan los síntomas de la enfermedad, pero también a las que transmiten la enfermedad a través de los mosquitos, evitando así que el parásito cause la enfermedad en el huésped humano. Los experimentos han demostrado que cuando se agrega un inhibidor de PKG a las etapas transmisibles (gametocitos), el parásito no puede crecer en el mosquito e infectar a un nuevo huésped, "dijo Calmettes.