Gráficamente abstracto. Crédito: Química bioorgánica (2021). DOI:10.1016 / j.bioorg.2021.104721
Un consorcio de investigadores de Rusia, Bielorrusia, Japón, Alemania y Francia, dirigidos por un científico de Skoltech, han descubierto la forma en que Mycobacterium tuberculosis sobrevive en condiciones de deficiencia de hierro mediante el uso de rubredoxina B, una proteína de la familia de las rubredoxinas que juega un papel importante en la adaptación a las condiciones ambientales cambiantes. El nuevo estudio es parte de un esfuerzo por estudiar el papel de las enzimas de M. tuberculosis en el desarrollo de resistencia al sistema inmunológico humano y a la medicación. El artículo fue publicado en la revista Química bioorgánica .
Según la Organización Mundial de la Salud, cada año, 10 millones de personas enferman de tuberculosis y alrededor de 1,5 millones mueren a causa de ella, convirtiéndolo en el principal asesino infeccioso del mundo. La bacteria que causa la TB, Tuberculosis micobacteriana, es conocido por su capacidad para sobrevivir dentro de los macrófagos, células del sistema inmunológico que destruyen las bacterias dañinas. La continua propagación de la farmacorresistencia de M. tuberculosis a terapias ampliamente utilizadas durante las últimas décadas se convirtió en un problema clínico sustancial. A este respecto, la identificación de nuevos objetivos de fármacos moleculares y el descifrado de los mecanismos moleculares de la resistencia a los fármacos son de vital importancia.
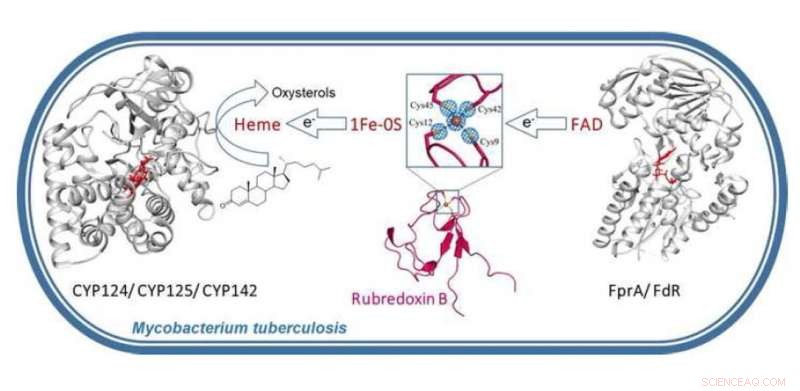
Natallia Strushkevich, Profesor asistente en el Centro Skoltech de Ciencia e Ingeniería Computacional e Intensiva en Datos (CDISE), y sus colegas estudiaron la estructura cristalina y la función de la rubredoxina B (RubB), una metaloproteína que asegura el funcionamiento adecuado de las proteínas del citocromo P450 (CYP) esenciales para la supervivencia y patogenicidad bacterianas. El equipo plantea la hipótesis de que M. tuberculosis cambió a RubB más eficiente en hierro para sobrevivir a la inanición de hierro cuando se forman los granulomas (estos son intentos en gran parte infructuosos de defensa contra la tuberculosis por parte del sistema inmunológico).
"Durante la coevolución a largo plazo con los mamíferos, M. tuberculosis desarrolló una variedad de estrategias para subvertir o evadir la respuesta inmune innata del huésped, del reconocimiento de la bacteria y las defensas fagosómicas dentro de los macrófagos infectados, a las respuestas inmunitarias adaptativas de las células presentadoras de antígenos.
"Asimilación de hierro, el almacenamiento y la utilización son esenciales para la patogénesis de M. tuberculosis y también participan en la aparición de cepas resistentes a múltiples y extensivamente a los medicamentos. El hemo es la fuente de hierro preferible para M. tuberculosis y actúa como cofactor de varias enzimas metabólicas. Basado en nuestro hallazgo, vinculamos la rubredoxina B con las hemo monooxigenasas importantes para el metabolismo de los oxiesteroles inmunes del huésped y los fármacos antituberculosos. Nuestros hallazgos indican que M. tuberculosis tiene su propio sistema de transformación de xenobióticos que se asemeja al sistema de metabolización de fármacos humanos, "explica Natallia Strushkevich.
Según Natallia:Los nuevos objetivos para los esfuerzos de diseño de fármacos tienen una gran demanda y las enzimas del citocromo P450 han surgido como nuevos objetivos para el desarrollo de agentes terapéuticos contra la tuberculosis. Los enfoques clásicos para bloquear estas enzimas no son sencillos. Encontrar el socio redox alternativo, como RubB, permite una mayor comprensión de su función en diferentes microambientes de acogida. Este conocimiento podría aprovecharse para identificar nuevas formas de bloquear su función en M. tuberculosis.
Una investigación anterior del consorcio mostró que uno de los CYP habilitados por RubB puede actuar contra SQ109, un fármaco candidato prometedor contra la tuberculosis multirresistente. Otro estudio se centró en cómo Mycobacterium tuberculosis se protege interceptando moléculas de señalización inmunitaria humana, un obstáculo que limita el descubrimiento de fármacos.