Crédito:Wiley
Indoles, y estructuras derivadas de ellos, son un componente de muchas sustancias naturales, como el aminoácido triptófano. Una nueva reacción catalítica produce ciclopenta [b] indoles, estructuras formadas por tres anillos que se unen en los bordes, de manera muy selectiva y con la estructura espacial deseada. Como informa un equipo de investigación en la revista Angewandte Chemie , las velocidades de los diferentes pasos de la reacción juegan un papel crítico.
Los derivados del indol se encuentran ampliamente distribuidos en la naturaleza; forman parte de la serotonina y la melatonina, así como muchos alcaloides, algunos de los cuales se utilizan como medicamentos, por ejemplo, como tratamientos para la enfermedad de Parkinson. El indol es un anillo aromático de seis miembros fusionado con un anillo de cinco miembros a lo largo de un borde. El anillo de cinco miembros tiene un doble enlace y un átomo de nitrógeno. La estructura básica de indol puede equiparse con una variedad de grupos laterales o unirse a anillos adicionales. El indol y muchos derivados de indol pueden obtenerse mediante una reacción de síntesis de indol desarrollada por Emil Fischer (condensación de cetonas asistida por ácido con fenilhidrazinas).
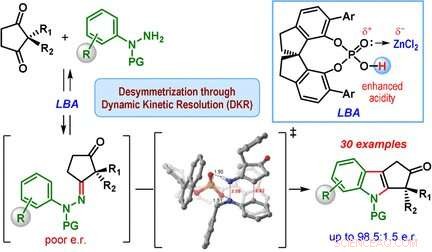
La clase más importante de derivados de indol son los indoles de ciclopentano [b], moléculas con una estructura formada por una unidad de indol y un anillo adicional de cinco miembros. Este anillo de cinco miembros puede contener un centro de carbono quiral, que es un carbono de anillo que tiene dos grupos laterales adicionales, y se puede organizar de dos maneras que son imágenes especulares entre sí. Solo uno de los dos enantiómeros, o imágenes de espejo, se encuentra en la naturaleza. Sin embargo, la síntesis clásica de indol de Fischer produce una mezcla de ambos enantiómeros.
Un equipo dirigido por Santanu Mukherjee y Garima Jindal en el Instituto de Ciencias de la India, Bangalore (India) ha desarrollado ahora una versión catalítica de la síntesis de indol de Fischer que produce principalmente uno de los enantiómeros (es decir, la reacción es enantioselectiva). Los materiales de partida son una clase de dicetonas (2, Ciclopentano-1-2-disustituido, 3-dionas) y derivados de fenilhidrazina equipados con grupos protectores especiales. El secreto de su éxito es un catalizador especial:un quiral, ácido fosfórico cíclico. La reacción se lleva a cabo en presencia de cloruro de zinc como cocatalizador y una resina de intercambio catiónico ácida. que captura el amoniaco que se forma como subproducto.
El corazón del mecanismo de reacción se llama resolución cinética dinámica. Durante la reacción, en primer lugar, se forma una hidrazona quiral como intermedio en ambas formas enantioméricas. Este paso es reversible, de modo que ambas hidrazonas enantioméricas puedan interconvertirse durante el curso de la reacción. La reacción de las hidrazonas para producir los derivados de indol es la reacción catalítica real. Esta reacción es mucho más rápida para uno de los enantiómeros de hidrazona en comparación con el otro porque una forma tiene una geometría más favorable cuando se une al catalizador quiral. El otro enantiómero de hidrazona reacciona muy lentamente y conduce solo a una pequeña cantidad del producto indol. En lugar de, el enantiómero de hidrazona de reacción lenta se convierte en el enantiómero de hidrazona de reacción rápida, provocando que el equilibrio cambie eventualmente al producto ciclopentano [b] indol.
Este método hizo posible que el equipo produjera muchos derivados de indol diferentes con rendimientos moderados, pero con una selectividad enantiomérica de buena a excelente.