
La profesora asistente del MIT Betar Gallant (izquierda) y la estudiante de posgrado Aliza Khurram están desarrollando una batería novedosa que podría capturar dióxido de carbono en el escape de la planta de energía y convertirlo en un sólido listo para su eliminación segura. Crédito:Stuart Darsch
Reducir el dióxido de carbono (CO 2 ) las emisiones de las centrales eléctricas se considera en general un componente esencial de cualquier plan de mitigación del cambio climático. Muchos esfuerzos de investigación se centran en el desarrollo y despliegue de sistemas de captura y secuestro de carbono (CCS) para mantener el CO 2 emisiones de las centrales eléctricas fuera de la atmósfera. Pero separando el CO capturado 2 y convertirlo de nuevo en un gas que se puede almacenar puede consumir hasta el 25 por ciento de la capacidad de generación de energía de una planta. Además, El co 2 El gas generalmente se inyecta en formaciones geológicas subterráneas para su almacenamiento a largo plazo, un método de eliminación cuya seguridad y confiabilidad no han sido probadas.
Un mejor enfoque sería convertir el CO capturado 2 en productos útiles como combustibles o productos químicos con valor agregado. Con ese fin, la atención se ha centrado en los procesos electroquímicos, en este caso, un proceso en el que las reacciones químicas liberan energía eléctrica, como en la descarga de una batería. El medio ideal para realizar la conversión electroquímica de CO 2 parecería ser agua. El agua puede proporcionar los protones (partículas con carga positiva) necesarios para producir combustibles como el metano. Pero el funcionamiento de estos sistemas "acuosos" (basados en agua) requiere grandes aportes de energía, y solo una pequeña fracción de los productos formados son típicamente los de interés.
Betar Gallant, un profesor asistente de ingeniería mecánica, y su grupo en el MIT, por lo tanto, se han centrado en reacciones electroquímicas no acuosas (sin agua), en particular, los que ocurren dentro del litio-CO 2 baterías.
Investigación sobre litio-CO 2 baterías está en sus primeras etapas, según Gallant, pero el interés en ellos está creciendo porque el CO 2 se agota en las reacciones químicas que ocurren en uno de los electrodos cuando se descarga la batería. Sin embargo, CO 2 no es muy reactivo. Los investigadores han intentado acelerar las cosas utilizando diferentes electrolitos y materiales de electrodos. A pesar de tales esfuerzos, ha persistido la necesidad de utilizar catalizadores metálicos caros para provocar actividad electroquímica.
Dada la falta de avances, Gallant quería probar algo diferente. "Estábamos interesados en intentar aportar una nueva química para resolver el problema, ", dice. Y contar con la ayuda de las moléculas absorbentes que capturan CO de forma tan eficaz 2 en CCS parecía un camino prometedor a seguir.
Repensar la amina
La molécula sorbente utilizada en CCS es una amina, un derivado del amoniaco. En CCS, el escape se burbujea a través de una solución que contiene amina, y la amina se une químicamente al CO 2 , eliminándolo de los gases de escape. El co 2 —Ahora en forma líquida— luego se separa de la amina y se convierte nuevamente en gas para su eliminación.

La estudiante de posgrado Aliza Khurram se prepara para los experimentos bombeando dióxido de carbono a través de una celda electroquímica que consta de electrodos de litio y carbono más un electrolito especialmente diseñado. Crédito:Stuart Darsch
En CCS, esos últimos pasos requieren altas temperaturas, que se logran utilizando parte de la producción eléctrica de la planta de energía. Gallant se preguntó si su equipo podría utilizar reacciones electroquímicas para separar el CO 2 de la amina, y luego continuar la reacción para hacer un sólido, CO 2 -producto que contiene. Si es así, el proceso de eliminación sería más sencillo que el del CO gaseoso 2 . El co 2 estaría más densamente empaquetado, por lo que ocuparía menos espacio, y no pudo escapar, por lo que sería más seguro. Mejor aún, Se podría extraer energía eléctrica adicional del dispositivo a medida que se descarga y forma el material sólido. "La visión era colocar un dispositivo similar a una batería en el flujo de desechos de la planta de energía para secuestrar el CO capturado 2 en un sólido estable, mientras se recolecta la energía liberada en el proceso, "dice Gallant.
La investigación sobre la tecnología CCS ha generado una buena comprensión del proceso de captura de carbono que tiene lugar dentro de un sistema CCS. Cuando CO 2 se agrega a una solución de amina, Las moléculas de las dos especies se combinan espontáneamente para formar un "aducto, "una nueva especie química en la que las moléculas originales permanecen en gran parte intactas. En este caso, el aducto se forma cuando un átomo de carbono en un CO 2 molécula se une químicamente con un átomo de nitrógeno en una molécula de amina. Mientras se combinan, El co 2 La molécula se reconfigura:cambia de su original, altamente estable, de forma lineal a una forma "doblada" con una carga negativa, una forma altamente reactiva que está lista para una reacción posterior.
En su plan, Gallant propuso usar electroquímica para romper el CO 2 -Aducto de amina:justo en el enlace carbono-nitrógeno. Escindir el aducto en ese enlace separaría las dos piezas:la amina en su original, estado sin reaccionar, listo para capturar más CO 2 , y el doblado, forma químicamente reactiva de CO 2 , que luego podría reaccionar con los electrones y los iones de litio cargados positivamente que fluyen durante la descarga de la batería. El resultado de esa reacción podría ser la formación de carbonato de litio (Li 2 CO 3 ), que se depositaría en el electrodo de carbono.
Al mismo tiempo, las reacciones en el electrodo de carbono deberían promover el flujo de electrones durante la descarga de la batería, incluso sin un catalizador metálico. "La descarga de la batería se produciría de forma espontánea, "Dice Gallant." Y romperíamos el aducto de una manera que nos permita renovar nuestro CO 2 absorbedor mientras toma CO 2 a un establo, forma sólida ".
Un proceso de descubrimiento
En 2016, La galante estudiante de doctorado en ingeniería mecánica Aliza Khurram comenzó a explorar esa idea.
Su primer desafío fue desarrollar un electrolito novedoso. Un litio-CO 2 La batería consta de dos electrodos, un ánodo de litio y un cátodo de carbono, y un electrolito, una solución que ayuda a transportar partículas cargadas de un lado a otro entre los electrodos a medida que se carga y descarga la batería. Por su sistema, necesitaban un electrolito hecho de amina más CO capturado 2 disuelto en un solvente, y necesitaba promover reacciones químicas en el cátodo de carbono cuando la batería se descargaba.
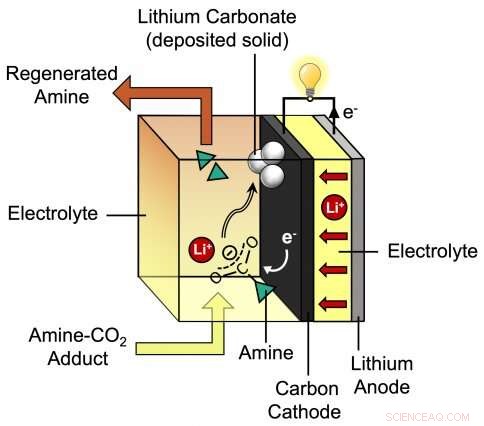
Este diagrama muestra el proceso durante la descarga de la nueva batería de litio-CO2 desarrollada por la profesora asistente del MIT Betar Gallant y su grupo. La batería propuesta por los investigadores consta de un ánodo de litio más un cátodo de carbono que está rodeado por un electrolito especial que incorpora iones de litio (Li +) y amina. Crédito:Instituto de Tecnología de Massachusetts
Empezaron probando posibles disolventes. Mezclaron su CO 2 -absorber amina con una serie de disolventes que se utilizan con frecuencia en las baterías y luego burbujear CO 2 a través de la solución resultante para ver si CO 2 podría disolverse en altas concentraciones en este ambiente químico poco convencional. Ninguna de las soluciones de amina-solvente exhibió cambios observables cuando el CO 2 Fue presentado, sugiriendo que todos podrían ser candidatos solventes viables.
Sin embargo, para que funcione cualquier dispositivo electroquímico, el electrolito debe estar enriquecido con una sal para proporcionar iones cargados positivamente. Porque es una batería de litio, los investigadores comenzaron agregando una sal a base de litio, y los resultados experimentales cambiaron drásticamente. Con la mayoría de los candidatos solventes, la adición de la sal provocó instantáneamente que la mezcla formara precipitados sólidos o se volviera muy viscosa, resultados que los descartaron como solventes viables. La única excepción fue el disolvente dimetilsulfóxido, o DMSO. Incluso cuando la sal de litio estaba presente, el DMSO podría disolver la amina y el CO 2 .
"Descubrimos que, de manera fortuita, la sal a base de litio era importante para permitir que prosiguiera la reacción, "dice Gallant." Hay algo en el ion de litio cargado positivamente que se coordina químicamente con la amina-CO 2 efectuar la aducción, y juntas esas especies forman las especies reactivas electroquímicamente ".
Explorando el comportamiento de la batería durante la descarga
Para examinar el comportamiento de descarga de su sistema, los investigadores instalaron una celda electroquímica que consta de un ánodo de litio, un cátodo de carbono, y su electrolito especial, por simplicidad, ya cargado con CO 2 . Luego rastrearon el comportamiento de descarga en el cátodo de carbono.
Como esperaban, su electrolito especial en realidad promovió la reacción de descarga en la celda de prueba. "Con la amina incorporada en el electrolito a base de DMSO junto con la sal de litio y el CO 2 , vemos capacidades muy altas y voltajes de descarga significativos, casi tres voltios, "dice Gallant. Según esos resultados, llegaron a la conclusión de que su sistema funciona como un litio-CO 2 batería con capacidades y voltajes de descarga competitivos con los de las baterías de litio-gas de última generación.
El siguiente paso fue confirmar que las reacciones efectivamente separaban la amina del CO 2 y continuar la reacción para hacer CO 2 -productos derivados. Descubrir, los investigadores utilizaron una variedad de herramientas para examinar los productos que se formaron en el cátodo de carbono.

Esta imagen de microscopio electrónico de barrido (SEM) muestra el cátodo del sistema de dióxido de carbono y litio de los investigadores después de la descarga. El análisis de las estructuras esféricas confirma que están compuestas de Li2CO3. El recuadro muestra una imagen SEM del cátodo de carbono antes de la descarga. La ausencia de las esferas confirma que se formaron durante la descarga. Crédito:Instituto de Tecnología de Massachusetts
En una prueba, produjeron imágenes de la superficie del cátodo de post-reacción utilizando un microscopio electrónico de barrido (SEM). Inmediatamente evidentes fueron las formaciones esféricas con un tamaño característico de 500 nanómetros, distribuidos regularmente en la superficie del cátodo. Según Gallant, la estructura esférica observada del producto de descarga era similar a la forma de Li 2 CO 3 observado en otras baterías de litio. Esas esferas no eran evidentes en las imágenes SEM del cátodo de carbono "prístino" tomadas antes de que ocurrieran las reacciones.
Otros análisis confirmaron que el sólido depositado sobre el cátodo era Li 2 CO 3 . Incluía solo CO 2 -materiales derivados; no estaban presentes moléculas de amina ni productos derivados de ellas. Tomados en conjunto, esos datos proporcionan una fuerte evidencia de que la reducción electroquímica del CO 2 La amina cargada se produce a través de la escisión selectiva del enlace carbono-nitrógeno.
"Se puede pensar que la amina activa efectivamente la reactividad del CO 2 , "dice Gallant." Eso es emocionante porque la amina comúnmente utilizada en CO 2 La captura puede entonces realizar dos funciones críticas. Puede servir como absorbente, recuperando CO espontáneamente 2 de los gases de combustión e incorporándolo a la solución de electrolito. Y puede activar el CO 2 para otras reacciones que no serían posibles si la amina no estuviera allí ".
Direcciones futuras
Gallant enfatiza que el trabajo hasta la fecha representa solo un estudio de prueba de concepto. "Todavía hay mucha ciencia fundamental por comprender, " ella dice, antes de que los investigadores puedan optimizar su sistema.
Ella y su equipo continúan investigando las reacciones químicas que tienen lugar en el electrolito, así como la composición química del aducto que se forma, el "estado reactivo" en el que se realiza la electroquímica posterior. También están examinando el papel detallado de la composición de la sal.
Además, hay preocupaciones prácticas que considerar al pensar en el diseño de dispositivos. Un problema persistente es que el depósito sólido obstruye rápidamente el cátodo de carbono, por lo que no pueden ocurrir más reacciones químicas. En una configuración que están investigando, un diseño de batería recargable, el cátodo se descubre durante cada ciclo de carga y descarga. Las reacciones durante la descarga depositan el sólido Li 2 CO 3 , y las reacciones durante la carga lo despegan, poniendo los iones de litio y CO 2 de vuelta al electrolito, listo para reaccionar y generar más electricidad. Sin embargo, el CO capturado 2 luego vuelve a su forma gaseosa original en el electrolito. Sellar la batería bloquearía ese CO 2 dentro, lejos de la atmósfera, pero solo una cantidad limitada de CO 2 se puede almacenar en una batería determinada, por lo que el impacto general de usar baterías para capturar CO 2 las emisiones serían limitadas en este escenario.

Los investigadores utilizan esta configuración para probar la capacidad de almacenamiento y el voltaje de descarga de sus baterías. Crédito:Stuart Darsch
La segunda configuración que están investigando los investigadores, una configuración de solo descarga, aborda ese problema al no permitir nunca que el CO gaseoso 2 reformar. "Somos ingenieros mecánicos, Entonces, lo que realmente nos interesa hacer es desarrollar un proceso industrial en el que de alguna manera pueda cosechar mecánica o químicamente el sólido a medida que se forma, "Dice Gallant." Imagínese si por vibración mecánica pudiera quitar suavemente el sólido del cátodo, manteniéndolo despejado para una reacción sostenida. "Colocado dentro de una corriente de escape, tal sistema podría eliminar continuamente CO 2 emisiones, generando electricidad y quizás produciendo materiales sólidos valiosos al mismo tiempo.
Gallant y su equipo ahora están trabajando en ambas configuraciones de su sistema. "Aún no sabemos cuál es mejor para las aplicaciones, ", dice. Aunque cree que el litio-CO práctico 2 faltan años para las pilas, ella está emocionada por los primeros resultados, lo que sugiere que el desarrollo de nuevos electrolitos para preactivar el CO 2 podría conducir a CO alternativo 2 vías de reacción. Y ella y su grupo ya están trabajando en algunos.
Uno de los objetivos es reemplazar el litio con un metal que sea menos costoso y más abundante en la tierra. como sodio o calcio. Con financiación inicial de la Iniciativa Energética del MIT, el equipo ya ha comenzado a buscar un sistema basado en calcio, un material que aún no está bien desarrollado para aplicaciones de batería. Si el calcio-CO 2 la configuración funciona como ellos predicen, el sólido que se forma sería carbonato de calcio, un tipo de roca que ahora se usa ampliamente en la industria de la construcción.
Mientras tanto, Gallant y sus colegas están complacidos de haber encontrado lo que parece ser una nueva clase de reacciones para capturar y secuestrar CO 2 . "CO 2 la conversión se ha estudiado ampliamente durante muchas décadas, " ella dice, "por eso estamos emocionados de pensar que podemos haber encontrado algo que es diferente y nos brinda una nueva ventana para explorar este tema".
Esta historia se vuelve a publicar por cortesía de MIT News (web.mit.edu/newsoffice/), un sitio popular que cubre noticias sobre la investigación del MIT, innovación y docencia.