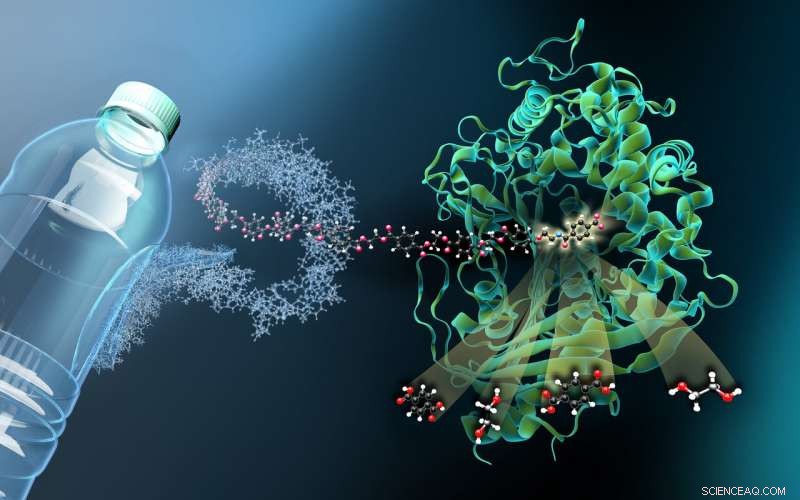
La imagen muestra la estructura de la MHETasa unida a un ligando derivado de PET no hidrolizable (MHETA). Las fibras de polímero simbólico conectan MHETA a una botella de PET típica, lo que indica el gran potencial de las variantes mejoradas de PETasa y MHETasa en el reciclaje enzimático de plástico. A este respecto, Nuestros datos estructurales facilitaron la generación de variantes iniciales de MHETasa con actividad mejorada y especificidad de sustrato extendida. Por lo tanto, nuestros hallazgos representan un paso importante en el camino hacia un sistema PETase / MHETase mejorado en el que el reciclaje de PET se desacopla de su dependencia del petróleo crudo de una manera sostenible y que ahorra energía. Crédito:Martin Künsting / HZB
Un equipo de investigación de la Universidad de Greifswald y Helmholtz-Zentrum-Berlin (HZB) ha resuelto la estructura molecular de la enzima MHETase en BESSY II. MHETase se descubrió en bacterias, y junto con una segunda enzima, PETasa, es capaz de descomponer el plástico PET ampliamente utilizado en sus componentes básicos. Esta estructura 3D ya permitió a los investigadores producir una variante de MHETase con actividad optimizada para poder usarla, junto con PETase, para un reciclaje sostenible de PET.
Los plásticos son extremadamente versátiles y casi eternamente duraderos. Pero esto también es un problema, porque después de solo unos 100 años de producir plásticos, Las partículas de plástico ahora se encuentran en todas partes:en el agua subterránea, en los océanos, en el aire, y en la cadena alimentaria. Cada año se producen alrededor de 50 millones de toneladas del polímero PET de importancia industrial. En la actualidad, solo una pequeña fracción del plástico se recicla a través de procesos costosos y que consumen energía que producen productos degradados o dependen a su vez de agregar petróleo crudo 'fresco'.
En 2016, un grupo de investigadores japoneses descubrió una bacteria que crece en PET y se alimenta parcialmente de él. Descubrieron que la bacteria posee dos enzimas especiales, PETasa y MHETase, que digieren polímeros plásticos PET. PETase descompone el plástico en bloques de construcción de PET más pequeños, principalmente MHET, y MHETase divide esto en los dos bloques de construcción precursores básicos del PET, ácido tereftálico y etilenglicol. Ambos componentes son valiosos para sintetizar PET nuevo sin la adición de petróleo crudo para un ciclo cerrado de producción y recuperación sostenible.
En abril de 2018, La estructura de PETase finalmente fue resuelta de forma independiente por varios grupos de investigación. Diamond Light Source también participó en los experimentos. Sin embargo, PETase es solo una parte de la solución. Es igualmente importante caracterizar la estructura de la segunda enzima, MHETase.
"La MHETasa es considerablemente más grande que la PETasa e incluso más compleja. Una sola molécula de MHETasa consta de 600 aminoácidos, o alrededor de 4000 átomos. MHETase tiene una superficie que es aproximadamente dos veces más grande que la superficie de PETase y, por lo tanto, tiene un potencial considerablemente mayor de optimización hacia la descomposición de PET. "explica el bioquímico y biólogo estructural Dr. Gert Weber de Helmholtz-Zentrum Berlin y Freie Universität Berlin.
Durante una cátedra interina en la Universidad de Greifswald, Weber se puso en contacto con el biotecnólogo Prof. Uwe Bornscheuer en el Instituto de Bioquímica, que ya estaba involucrado con enzimas que degradan el plástico. Juntos, desarrollaron la idea de resolver la estructura de MHETase y luego utilizar esta información para optimizar la enzima para aplicaciones en el reciclaje de PET. Para hacer esto, primero tenían que extraer la enzima de las células bacterianas y purificarla. Dentro de esta colaboración, los equipos lograron obtener la compleja arquitectura tridimensional de MHETase en BESSY II, la fuente de sincrotrón en HZB en Berlín.
"Para ver cómo MHETase se une al PET y lo descompone, necesita un fragmento de plástico que se adhiera a MHETase pero que no se rompa, "explica Weber. Un miembro del equipo de investigación anterior de Weber en Greifswald, Dr. Gottfried Palm, cortar una botella de PET, descompuso químicamente el polímero PET y sintetizó un pequeño fragmento químico a partir de él que se une a MHETasa pero que ya no puede ser escindido por ella. De esta MHETase 'bloqueada', Se cultivaron pequeños cristales para investigaciones estructurales en el HZB. "Las investigaciones estructurales nos permitieron ver MHETase virtualmente 'en funcionamiento' y desarrollar estrategias sobre cómo optimizar esta enzima, "explica Weber.
"Gracias al formato de grupo de investigación conjunto, tenemos los medios para ofrecer acceso en tiempo de haz en las líneas de haz BESSY II MX altamente demandadas para realizar mediciones muy rápidamente en cualquier momento, "dice el Dr. Manfred Weiss, quién es responsable de las líneas de luz BESSY II MX. The three-dimensional architecture of MHETase actually displays some special features:enzymes such as MHETase bind to their target molecule first before a chemical reaction occurs. For breakdown of a molecule you need a tailor-made enzyme:"We can now exactly localise where the MHET molecule docks to MHETase and how MHET is then split into its two building blocks terephthalic acid and ethylene glycol, " says Weber.
Sin embargo, neither PETase nor MHETase are particularly efficient. "Plastics have only been around on this scale for a few decades—even bacteria with their rapid successions of generations and rapid adaptability have not managed to develop a perfect solution through the evolutionary process of trial and error over such a short time, " explains Weber. "Thanks to the clarification of the structure of this very important enzyme, we have now also been able to plan, produce and biochemically characterise variants that show significantly higher activity than natural MHETase and are even active against another intermediate product of PET degradation, BHET, " adds Uwe Bornscheuer.
En el futuro, Uwe Bornscheuer will work on systematically optimising the enzymes PETase and MHETase for their task—the decomposition of PET. Gert Weber plans to supplement these studies with further work on biological structures in order to systematically develop plastic-digesting enzymes for environmental applications. Access to the measuring stations and the IT infrastructure of HZB is indispensable for this.
Producing these kinds of enzymes in closed biotechnological cycles, por ejemplo, could be a way to really break down PET plastics and other polymers into their basic building blocks. This would also be the key to ideal recycling and a long-term solution to the plastic waste problem:production of plastic would be a closed cycle and no longer dependent on crude oil.
El estudio se publica en Comunicaciones de la naturaleza .