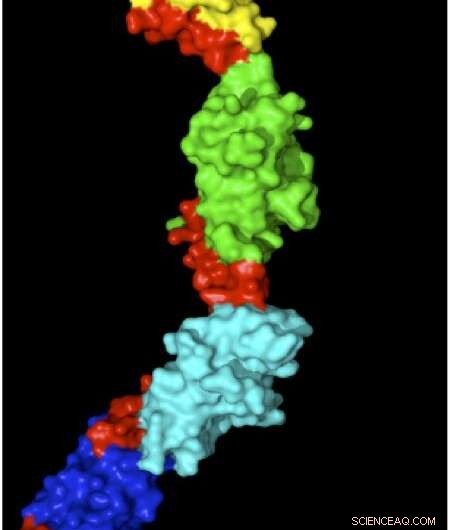
La estructura de la miomesina con regiones elásticas se muestra en rojo. Crédito:Matthias Wilmanns
Las proteínas producidas en nuestras células se doblan en formas específicas para que puedan cumplir sus funciones. Los científicos han descubierto las estructuras estáticas de más de 100, 000 proteínas, pero cómo cambian en respuesta a las fuerzas en la célula, como contracciones musculares, es en gran parte desconocido. Matthias Wilmanns y colegas del Laboratorio Europeo de Biología Molecular en Hamburgo, Alemania, desarrollaron métodos para estudiar la estructura de una proteína "absorbente de tensión" a medida que cambia durante las contracciones musculares. Presentarán su trabajo en la 63a Reunión Anual de la Sociedad Biofísica, que se celebrará del 2 al 6 de marzo, 2019 en Baltimore, Maryland.
Cada unidad muscular tiene una serie de barras de proteínas altamente organizadas que se tiran para superponerse cuando un músculo se contrae o se separan cuando se estira un músculo. La miomesina es una proteína que estabiliza y organiza estas varillas, actuando para absorber la tensión en los músculos estirados para evitar que las unidades musculares se rompan. Wilmanns, en colaboración con el grupo de Matthias Rief en la Universidad Técnica de Munich, utilizó microscopía de fuerza atómica para estirar y medir moléculas de miomesina individuales. Myomesin se hizo 2,5 veces más largo bajo la fuerza, y su estructura de alta resolución mostró que esto se debía a enlazadores de tipo slinky en la proteína que le permiten estirarse sin desplegarse. Sin embargo, Una cuestión clave sigue siendo demostrar que estos mecanismos también se aplican en condiciones fisiológicas. Para abordar esta pregunta, Wilmanns y sus colegas ahora están diseñando experimentos para visualizar los cambios en la miomesina dentro de las células musculares utilizando imágenes de súper alta resolución.
"El músculo es un buen modelo para observar cómo responden sus proteínas a la fuerza, porque experimenta fuerzas extraordinariamente altas, pero tenemos pequeñas fuerzas en todo el cuerpo, "explicó Wilmanns." Ahora tenemos métodos lo suficientemente sensibles para medir fuerzas muy pequeñas, para que podamos empezar a observar el comportamiento de diferentes proteínas que responden a fuerzas muy pequeñas. En la actualidad, se sabe muy poco sobre los mecanismos de elasticidad molecular de las proteínas ".