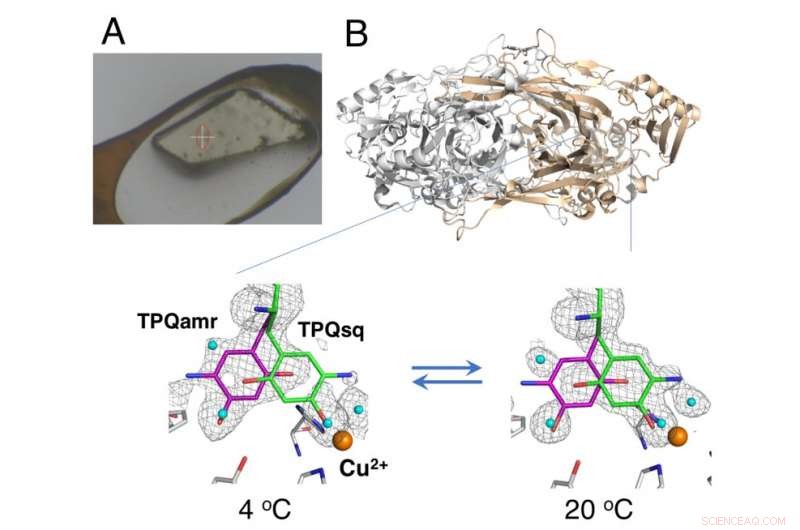
Cristal no crioenfriado montado utilizando el método HAG (A) y cambio de equilibrio dependiente de la temperatura de intermedios catalíticos en la amina oxidasa de cobre (B). Crédito:Universidad de Osaka
Las enzimas, biocatalizadores hechos de proteínas, son moléculas de enorme importancia que catalizan las reacciones y procesos en los organismos vivos. Por lo tanto, el trabajo continuo para comprender sus estructuras y mecanismos de reacción es vital para ampliar nuestro conocimiento y contribuir a los avances científicos y médicos.
Cristalografía de rayos X:en la que los cristales de proteínas se exponen a un haz de rayos X, que da como resultado patrones de difracción específicos que pueden analizarse, es la técnica más utilizada para la determinación estructural de proteínas. La recopilación de datos en cristalografía de rayos X generalmente implica colocar cristales bajo una corriente de gas criogénico a 100 K; sin embargo, las condiciones criogénicas generalmente no permiten el análisis termodinámico de los cambios conformacionales en los cristales de proteína. Ahora, investigadores de la Universidad de Osaka, Facultad de Medicina de Osaka, Instituto de Investigación de Radiación Sincrotrón de Japón (JASRI), y RIKEN han informado los detalles de los cambios estructurales durante la reacción catalítica de una amina oxidasa de cobre utilizando una técnica no criogénica. Sus hallazgos fueron publicados en PNAS .
El estudio utilizó un método de "aire húmedo y recubrimiento de pegamento (HAG)" desarrollado por JASRI en la instalación de sincrotrón SPring-8. En lugar de enfriamiento criogénico, los cristales de proteína no congelados se recubrieron con un polímero soluble en agua y se colocaron bajo una corriente de gas nitrógeno húmedo con temperatura controlada con precisión. Esto permitió que el cristal casi desnudo permaneciera lo suficientemente estable para que el equipo evaluara el equilibrio entre las conformaciones estructuralmente distintas del cofactor redox (un componente esencial de la reacción catalítica) a una temperatura particular.
"Como resultado del control preciso de la temperatura que pudimos lograr, demostramos el primer análisis exitoso en cristalo termodinámico de la enzima de trabajo, "dice el autor correspondiente del estudio Toshihide Okajima." Los análisis termodinámicos basados en mediciones de cristales brindan una representación más cercana de los cambios estructurales que los datos adquiridos de estudios de soluciones, y por lo tanto son más valiosos para nuestro entendimiento ".
Además, los parámetros termodinámicos obtenidos mostraron un comportamiento similar al del citosol dentro de las células. Por lo tanto, se cree que las condiciones de HAG pueden proporcionar un modelo útil para las condiciones fisiológicas. Se ha informado de varias otras técnicas cristalográficas para su uso a temperatura ambiente; sin embargo, requieren láseres sin rayos X especializados.
"Al utilizar el método HAG de temperatura controlada, Hemos demostrado que es posible adquirir información conformacional utilizando un haz de rayos X estándar, ", Explica Okajima." Esperamos que la accesibilidad de la técnica y sus posibilidades para proporcionar información termodinámica la conviertan en una importante adición a los enfoques cristalográficos actuales ".