Crédito:Wiley
Las reacciones acopladas de transferencia de oxígeno y de transferencia de electrones que utilizan cofactores son reacciones enzimáticas de importancia crucial para todas las formas de vida, desde las bacterias hasta los vertebrados. En el Revista europea de química inorgánica , Los científicos han introducido un modelo para la enzima sulfito oxidasa. Se basa en un complejo de molibdeno cuyos ligandos especiales se pueden oxidar para permitir el acoplamiento de la transferencia de oxígeno a un sustrato con una transferencia de electrones intramolecular. Los intermedios que contienen molibdeno (V) -ion juegan un papel fundamental.
Muchas enzimas no funcionan solas; requieren cofactores, componentes no proteicos que desempeñan un papel en la transferencia de electrones. Estos a menudo involucran iones metálicos, como el hierro en los citocromos o el oligoelemento molibdeno, que se encuentra en las oxotransferasas de molibdeno, enzimas que transfieren átomos de oxígeno a sustratos. Un representante importante de este último es la sulfito oxidasa, que oxida el sulfito tóxico para producir sulfato. La transferencia de oxígeno implica un cambio en el estado de oxidación del molibdeno de tetravalente (MoIV) a pentavalente (MoV). Los electrones implicados se eliminan mediante citocromos y se utilizan para la producción de ATP. El molibdeno pentavalente (MoV) parece ser un intermedio en la reacción.
Los investigadores que trabajan con Katja Heinze en la Universidad de Mainz han desarrollado ahora un enfoque conceptual para estabilizar y caracterizar espectroscópicamente los intermedios predichos en las reacciones de oxotransferasas que contienen Mo mediante el uso de sistemas modelo. Utilizan un método que también se utiliza para controlar catalizadores:unen un "interruptor" molecular con un estado de oxidación controlable.
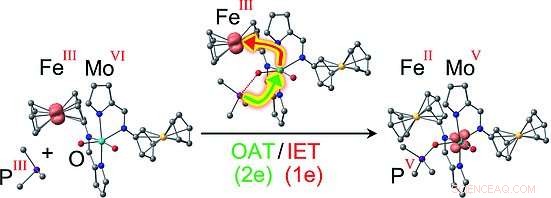
Los investigadores eligieron utilizar el par redox ferroceno / ferrocenio, en el que un átomo de hierro se intercala entre dos cargados negativamente, aromático, anillos de carbono de cinco miembros. El ion de hierro puede cambiar entre un estado con una carga positiva doble (FeII, ferroceno) y un triple cargado positivamente, estado oxidado (FeIII, ferrocenio). Esto es análogo a los cofactores del citocromo naturales, que también puede contener FeII o FeIII. Los investigadores conectaron dos de estos "interruptores" de ferroceno / ferrocenio a un complejo de molibdeno como modelo para el centro activo de una sulfito oxidasa. El molibdeno está en estado de oxidación VI y tiene dos átomos de oxígeno unidos por dobles enlaces. La reacción con un fosfano orgánico (una molécula de fósforo-hidrocarburo) como modelo de sustrato aceptor de oxígeno ocurre a velocidades variables, dependiendo de los cargos en los "interruptores", porque el estado redox de los sustituyentes ferrocenilo modula las barreras de energía para ciertos intermedios. Esto da como resultado una variedad de aductos entre el complejo de Mo y el fosfano.
Las versiones más interesantes son las que tienen dos iones FeIII o un FeII y un ion FeIII:En estos casos, el mecanismo ya no es una simple transferencia de un átomo de oxígeno al sustrato, como para la versión FeII / FeII. En cambio, está acoplado a una transferencia de electrones intramolecular, posiblemente similar conceptualmente a la de las sulfito oxidasas naturales. Durante la reacción de transferencia de oxígeno, un electrón se transfiere del molibdeno a uno de los iones FeIII, resultando en una distribución de carga de FeII FeIII MoV o FeII FeII MoV. Para la última versión, Los investigadores pudieron utilizar la espectroscopia de resonancia de espín de electrones para detectar de forma inequívoca el intermedio de MoV FeII FeII MoV con el sustrato oxidado (el producto) todavía unido a él. El acoplamiento de la transferencia de oxígeno a una transferencia de electrones intermolecular reduce la barrera de activación para este paso de reacción y simultáneamente estabiliza el intermedio MoV, según lo predicho por los modelos informáticos.
Los investigadores proponen utilizar este nuevo sistema como modelo para la transferencia de átomos de oxígeno y los pasos de transferencia de electrones intramoleculares en sulfito oxidasas. y espero utilizar este nuevo concepto para desarrollar análogos para más reacciones enzimáticas con transferencia de electrones acoplada. En el futuro, también parece posible extender este concepto a reacciones catalíticas conmutables que no tienen un prototipo natural.