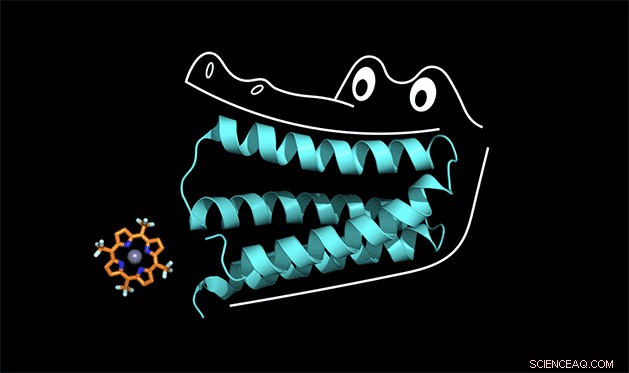
La proteína sintética reprime la porfirina como las mandíbulas de un caimán. Crédito:Nicholas Polizzi
Las proteínas tienen el poder de acelerar las reacciones bioquímicas dentro del cuerpo.
Sin la ayuda de tipos de proteínas llamadas enzimas, la reacción que construye el ADN podría tardar más de 130, 000 años para completar. Las enzimas reducen ese tiempo a unos pocos milisegundos.
Para acelerar las reacciones químicas, muchas proteínas se juntan con moléculas o metales más pequeños llamados cofactores. A los químicos les gustaría diseñar proteínas que se unan a cofactores no biológicos para acelerar las reacciones químicas que no se encuentran en la naturaleza. Pero primero, tienen que descubrir cómo crear proteínas artificiales que se adhieran a nuevos cofactores exactamente de la manera correcta, y eso no es tarea fácil.
Un equipo de químicos de Duke y UC San Francisco es el primero en resolver este rompecabezas de diseño de proteínas. El equipo creó una proteína sintética que se une estrechamente a un catalizador no biológico, un tipo de molécula llamada porfirina que es capaz de robar electrones de otras moléculas cuando absorbe luz.
"Ser capaz de combinar catalizadores artificiales con proteínas sería realmente importante en el campo de la química porque entonces se podría combinar el poder de una enzima con el de una reacción que no se encuentra en la naturaleza, "dijo el ex estudiante graduado de Duke Nicholas Polizzi, quien ahora es investigador postdoctoral en el laboratorio de William DeGrado en UCSF.
"Pudimos descubrir los criterios de diseño necesarios para colocar esa porfirina en una proteína con una precisión muy alta, ", Dijo Polizzi." Ese fue un gran trampolín para poder diseñar nuevas combinaciones de proteína-cofactor que no se ven en la naturaleza ".
Las proteínas están formadas por cadenas de cientos o miles de aminoácidos más pequeños que se retuercen y se enroscan en complejas formas tridimensionales que pueden entrelazarse con otras moléculas como piezas de un rompecabezas. Para catalizar reacciones químicas, Las combinaciones de proteína-cofactor mantienen dos o más moléculas en bolsas de forma precisa que mantienen las moléculas en las posiciones correctas. y proporcionar el entorno adecuado, para que ocurra una reacción química.
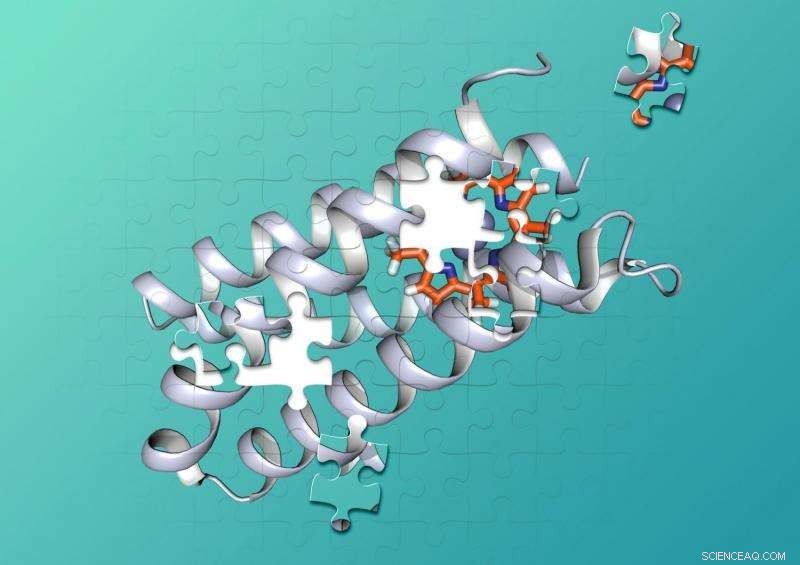
Los químicos de Duke y UCSF diseñaron una proteína sintética que se une fuertemente a una molécula no biológica. Crédito:Nicholas Polizzi
Millones de años de evolución han creado proteínas que se pliegan en formas que agarran con fuerza cofactores específicos y proporcionan los entornos perfectos para catalizar reacciones químicas.
Durante más de 25 años, Los químicos han utilizado lo que saben sobre el plegamiento de proteínas para diseñar secuencias de aminoácidos sintéticos que se retuercen en formas útiles. Pero hasta ahora, no han podido diseñar una proteína que se una a un cofactor no biológico con la precisión necesaria para impulsar nuevas reacciones químicas complejas.
Polizzi dijo que esto puede deberse a que estos diseños se centraron principalmente en el "sitio de unión" donde los cofactores y las moléculas de reacción encajan en la proteína. ignorando el resto de la estructura. "Lo que hice de manera diferente es que consideré esencialmente todo el interior de la proteína como el sitio de unión de la porfirina, a diferencia de unos pocos aminoácidos que tocan la porfirina, "Dijo Polizzi.
Para entender cómo funciona esto, puedes pensar en la proteína como la boca de un caimán, dijo Michael Therien, William R. Kenan Jr. Profesor de Química en Duke. La proteína se adhiere a un cofactor de la misma manera que un cocodrilo usa sus dientes frontales para masticar en la cena. Pero para que los dientes frontales tengan un agarre fuerte, la mandíbula y los dientes posteriores también deben diseñarse correctamente.
"El nuevo concepto aquí es que la región de no unión de la proteína se mantiene en una forma que permite que funcione la región de unión, "Dijo Therien.
"Llamamos a la proteína 'cocodrilo' en el laboratorio, "Dijo Polizzi.
Las mandíbulas de la proteína cocodrilo en realidad aprietan con tanta fuerza el cofactor de porfirina que toda la estructura es demasiado rígida para catalizar una reacción. Dijo Polizzi. Pero con algunos ajustes para aflojar la estructura, cree que puede hacer que funcione.
"En esta reacción, muchas veces necesitas un poco de margen de maniobra en la proteína para que se mueva. Y no había margen de maniobra en nuestra proteína, todo encaja demasiado a la perfección, "Dijo Polizzi.