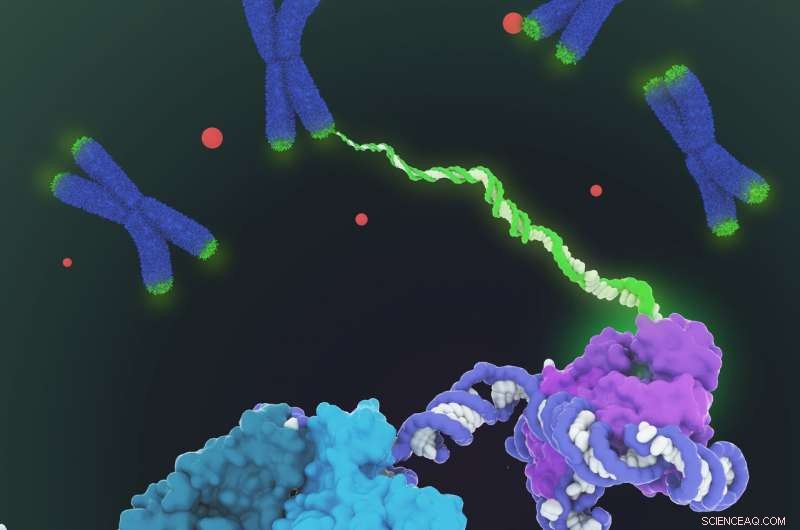
Se muestra el modelo de llenado de espacio de la estructura de la holoenzima de la telomerasa humana determinada por microscopía crioelectrónica (crio-EM). La telomerasa cataliza la síntesis de ADN telomérico (verde) en los extremos de los cromosomas (azul) para compensar la pérdida de telómeros durante la replicación del genoma. La estructura comprende dos lóbulos con distintas funcionalidades:el núcleo catalítico (violeta) responsable de la síntesis de ADN y un lóbulo de ribonucleoproteína H / ACA (cian, verde azulado y verde claro) importante para la biogénesis de la telomerasa y la localización en el cuerpo de Cajal (puntos rojos y parte inferior izquierda en primer plano). Dado que la regulación de la telomerasa está implicada en el cáncer y el envejecimiento, esta primera visualización arquitectónica de la telomerasa humana representa un avance importante en el campo de la telomerasa y el diseño terapéutico basado en la telomerasa. Crédito:Janet Iwasa
Hace más de 30 años, cuando la Universidad de California, Los investigadores de Berkeley descubrieron la telomerasa, una enzima que alarga los extremos de los cromosomas y evita que se deshilachen lo suficiente como para matar una célula. Se especula sobre su papel en el envejecimiento y el cáncer. activar una prensa en toda la cancha para producir medicamentos que activen o bloqueen la enzima.
Si bien ninguno de los medicamentos antienvejecimiento basados en telomerasa, promocionado como una "fuente de la juventud, "ni han aparecido todavía medicamentos contra el cáncer, La publicación de hoy por científicos de UC Berkeley de la primera imagen detallada de la estructura molecular de la telomerasa humana debería impulsar ese esfuerzo, permitiendo pruebas de detección de drogas más específicas y un diseño inteligente de nuevas drogas.
"Ha tardado mucho en llegar. Se necesitó mucha perseverancia, "dijo Kathleen Collins, un profesor de biología molecular y celular de UC Berkeley que ha trabajado en la enzima durante 26 años.
Collins y Eva Nogales, también profesor de biología molecular y celular, son los autores principales de un artículo que describe la estructura molecular 3-D de la enzima telomerasa humana publicado esta semana en la revista Naturaleza .
Un cuello de botella ha sido la obtención de muestras puras de esta compleja molécula, que se compone de una columna vertebral de ARN decorada por seis tipos de proteínas que se mueven a medida que agregan ADN a los extremos de los cromosomas. Los laboratorios de todo el mundo han debatido si la enzima funciona individualmente o como siameses, y cómo y cuántas proteínas decoran la columna vertebral del ARN.
Sin consenso sobre estas cuestiones, Ha resultado difícil diseñar un fármaco que se dirija a la máquina molecular y destruya la actividad de la telomerasa, lo que podría detener un cáncer que ha aumentado sus niveles de telomerasa, o reiniciar la telomerasa. quizás para preparar al cuerpo para una rápida división celular después de un trasplante de médula ósea.
La estructura recién revelada todavía carece de detalles finos, pero combinado con el conocimiento de la secuencia genética de la telomerasa humana, proporciona suficiente información para empezar a pensar en los posibles objetivos de las drogas, dijo el primer autor Thi Hoang Duong "Kelly" Nguyen, becario postdoctoral del Miller Institute en UC Berkeley.
"Las mejores imágenes anteriores de la telomerasa humana tenían una resolución de solo 30 Ångstroms; pudimos obtener una resolución de entre 7 y 8 Ångstroms utilizando microscopía crioelectrónica, ", Dijo Kelly." Cuando llegué al punto en el que podía ver todas las subunidades (teníamos 11 subunidades de proteínas en total), fue un momento de, 'Guau, Guau, así es como encajan todos juntos '".
Nguyen, Collins y Nogales están trabajando activamente para mejorar la resolución a 3 o 4 Ångstroms, aproximadamente del tamaño de dos átomos de carbono, que es suficiente para el diseño de fármacos.
La telomerasa rellena los telómeros.
Los telómeros fueron detectados por primera vez a nivel molecular a fines de la década de 1970 por Elizabeth Blackburn, luego en UC Berkeley y ahora presidente emérita del Instituto Salk de Estudios Biológicos en La Jolla, California. Trabajando con el protozoo ciliado Tetrahymena, ella y sus colegas demostraron que los extremos de los cromosomas están cubiertos por secuencias repetidas de ADN. Armados con el conocimiento de la secuencia de los telómeros, Luego, los investigadores demostraron que los telómeros en los tejidos de los organismos multicelulares se acortan cada vez que una célula se divide. Los telómeros protegen las hebras de ADN para que no se deshilachen y se dañen en sus extremos. muy parecido a la punta de plástico en el extremo de un cordón de zapato. Se cree que el hecho de que disminuyan con cada división celular nos protege del cáncer, cuando una célula es secuestrada y prolifera continuamente.
En 1985 en UC Berkeley, Blackburn y la entonces estudiante de posgrado Carol Greider descubrieron la telomerasa, una enzima que agrega ADN a los extremos de los cromosomas, alargándolos y alargando la vida útil de la célula. Quemadura negra, Greider y otro colega, Jack Szosak, compartió el Premio Nobel de Fisiología o Medicina 2009 por el descubrimiento de la telomerasa.
Desde entonces, los científicos han descubierto que en humanos y otros organismos multicelulares, la telomerasa se expresa solo en el embrión, no en la mayoría de las células adultas. Eso significa que la mayoría de las células al nacer tienen una capacidad predeterminada para crecer y dividirse. después de lo cual mueren. Muchos científicos creen que los telómeros agotados son una de las principales causas del envejecimiento.
Collins ha estado tratando de determinar la estructura de la telomerasa desde que se descubrió la primera proteína telomerasa humana en 1997. y ella y sus colegas han descubierto y caracterizado extensamente muchas de las proteínas en la enzima grande, así como la estructura en horquilla rota de la columna vertebral del ARN de la telomerasa. Sin embargo, cómo encajaban todos juntos era un enigma debido a los resultados contradictorios de muchos laboratorios diferentes.
Nguyen pudo aislar la enzima activa y purificarla mucho mejor que nadie antes, y empleó una nueva, Microscopio crioelectrónico de última generación para determinar la estructura de la telomerasa activa sin ambigüedades. Cryo-EM es una técnica para determinar estructuras moleculares de compuestos que no se pueden cristalizar y obtener imágenes con rayos X, y sus desarrolladores ganaron el Premio Nobel de Química 2017.
Una vez que el equipo de UC Berkeley tuvo la estructura, Nguyen dijo, quedó claro por qué las mutaciones genéticas en algunas de las proteínas de la telomerasa interfieren con la enzima para causar enfermedades. En 1999, Collins descubrió la primera enfermedad humana conocida causada por una mutación de la telomerasa:una mutación en una proteína de la telomerasa llamada disquerina que es responsable de una enfermedad rara llamada disqueratosis congénita. Los pacientes desarrollan anemia, así como problemas cutáneos e intestinales. y con mayor frecuencia mueren por insuficiencia de la médula ósea.
La razón, Collins dice, es que hay dos moléculas de disquerina unidas a la columna vertebral del ARN que no solo deben llegar a la red de otras proteínas, sino que también deben tocarse entre sí, y las mutaciones que causan enfermedades previenen estos vínculos, paralizando la capacidad de la columna vertebral del ARN para sobrevivir en las células. Algunos niños con disqueratosis congénita tienen niveles de telomerasa alrededor del 25 por ciento de lo normal y una esperanza de vida de menos de dos décadas. Aquellos con la mitad del nivel normal de telomerasa suelen llegar a una crisis de salud en la mediana edad.
Collins está encantada de tener finalmente una estructura definitiva para la telomerasa y espera aprender más sobre el intrincado proceso de ensamblaje de una de las enzimas más complejas del cuerpo:una polimerasa tan complicada como el ribosoma. que lee ARN para producir proteínas.
"No pensé que sería tan complicado cuando decidí estudiar esta molécula, ", dijo." Sentí curiosidad por saber cómo funciona la telomerasa en 1991, cuando estaba terminando como estudiante de posgrado, y estaba buscando un sistema de polimerasa realmente simple en el que comprender las interacciones de los ácidos nucleicos. Y yo pensé, Dios mío, no puedes ser más simple que esto. Eso fue super ingenuo ".